针对免疫系统“刹车”的新型癌症候选药物
人类免疫系统有强大的能力抵御入侵者,从病毒、细菌到癌细胞。但它也有一系列的制衡,分子制动器,以防止不必要的免疫反应。在癌症患者中,这些“刹车”可以阻止免疫系统释放出对抗肿瘤细胞的全部潜能。
现在,芝加哥大学的研究人员设计了一种潜在的治疗方法,可以抑制调节T细胞的活性。该分子在杂志的网上被描述过美国国家科学院院刊,可能会带来新的癌症免疫疗法。
“我们认为这种分子有潜力揭开免疫面纱,使肿瘤中的免疫反应更加活跃,”该论文的资深合著者James LaBelle副教授说。
芝加哥大学普利兹克分子工程学院(PME)院长马修·蒂雷尔(Matthew Tirrell)补充说:“这是一种全新的、不同的癌症治疗方法。”他是这项新研究的共同资深作者。“这也证明了我们在PME的研究人员擅长的分子工程。”
一个很难锁定的细胞
大多数免疫细胞引发或实施对病原体的炎症反应。调节性T细胞(treg),然而,是维和人员免疫系统,负责抑制免疫反应,预防慢性炎症或自身免疫疾病。
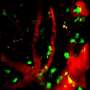
几十年来,科学家们已经知道,较高水平的treg在癌症患者与更短的存活时间相关——因为这些细胞阻止了对肿瘤细胞的其他免疫反应。然而,由于treg细胞外的几乎所有分子都与其他类型T细胞周围的分子相同,阻断这些免疫制动系统就变得复杂起来。
“不幸的是,调节性T细胞和其他免疫细胞一样,拥有大多数正常的膜成分,”LaBelle说。“因此,在不阻碍所有其他更有帮助的T细胞的情况下摆脱调节性T细胞是一个真正的挑战。”
由于Treg细胞的外部几乎没有可供药物靶向的选择,LaBelle、Tirrell和他们的同事将目光投向了细胞内部。虽然开发渗透细胞的药物更具挑战性,但考虑到treg的内部机制,有更多独特的分子。
模仿一个分子
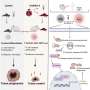
研究人员将重点放在FOX3P上,这是一种蛋白质,对许多Treg基因起转录因子或主开关作用,但对其他类型的T细胞并不重要。阻断FOX3P,通过关闭这些Treg基因,可以阻止Treg进行正常功能。
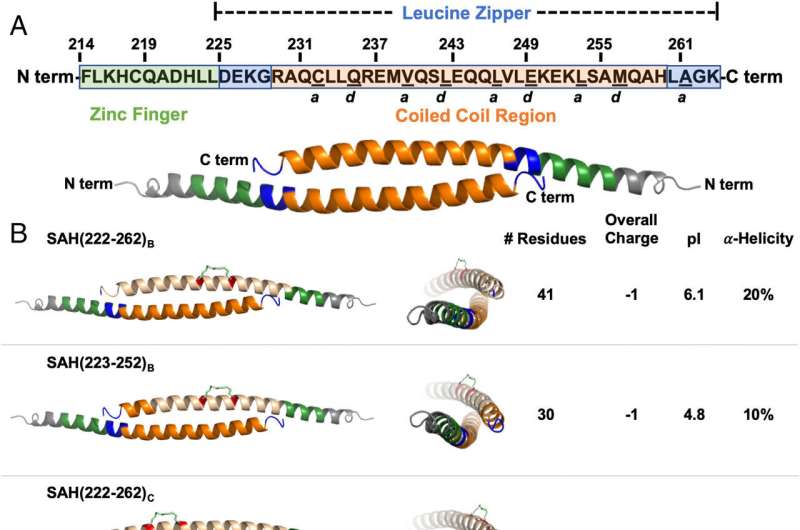
研究小组知道FOX3P分子必须配对才能完成它们的工作;两个附着的FOX3P副本形成了活性蛋白。为了阻止这种相互作用(称为同型二聚),研究人员设计了一种药物,它模仿了FOX3P的一个部分,称为碳氢化合物钉接α -螺旋肽。他们测试了几十种SAH版本,最终确定了一种成功破坏FOX3P同型二聚体的SAH。
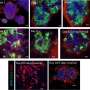
在一系列的实验中,该小组表明新的SAH可以进入T细胞并有效地改变表达水平所有已知的受FOX3P调控的基因。反过来,这些变化降低了treg的活性。
“到目前为止,我们所知道的是,如果我们能让这些分子模拟物进入调节性T细胞,它似乎抑制了它们的抑制能力——这是双重阴性,”LaBelle说。
走向诊所
LaBelle的团队正在继续与Tirrell的实验室合作,后者专门开发纳米颗粒,包括那些可以携带像SAHs这样的药物的纳米颗粒。他们计划进行更多的实验,以找出将SAHs送入肿瘤周围treg的最佳方法。然后,他们希望在动物癌症模型上进行试验。
最终,在癌症患者接受其他免疫疗法治疗的同时,阻断带有SAHs的FOX3P可能是一种有效的抑制treg的方法,这些免疫疗法旨在提高对treg的免疫反应肿瘤细胞.
拉贝尔说:“下一步是对这些药物进行包装,使它们更好地发挥体内药物的作用。”“我们希望不断开发这些sah的新迭代,推动我们对它们如何工作的理解,并最终开发出一款产品。”
进一步探索