基于抗体的疗法消除了乳腺癌和胰腺癌小鼠模型中的循环肿瘤细胞
研究人员设计了一种基于抗体的治疗方法,可以消除乳腺癌和胰腺癌小鼠模型中的循环肿瘤细胞(ctc)。这项研究由马萨诸塞州总医院(MGH)的科学家领导,并发表在《柳叶刀》杂志上PNAS这是一种很有希望阻止癌症扩散的策略。
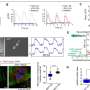
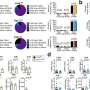
为了开发能够摧毁癌细胞的基于抗体的疗法,研究人员必须确定细胞表面蛋白区分癌症细胞从周围的正常细胞.相比之下肿瘤细胞在特定的器官或组织中出现的ctc,通过血液扩散或转移的ctc所处的细胞环境与它们本身有很大的不同,这就增加了供科学家识别的可靶向蛋白质的数量。研究人员发现,钙粘蛋白——通常介导细胞-细胞粘附的跨膜蛋白——在这种情况下是很好的候选者。
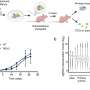
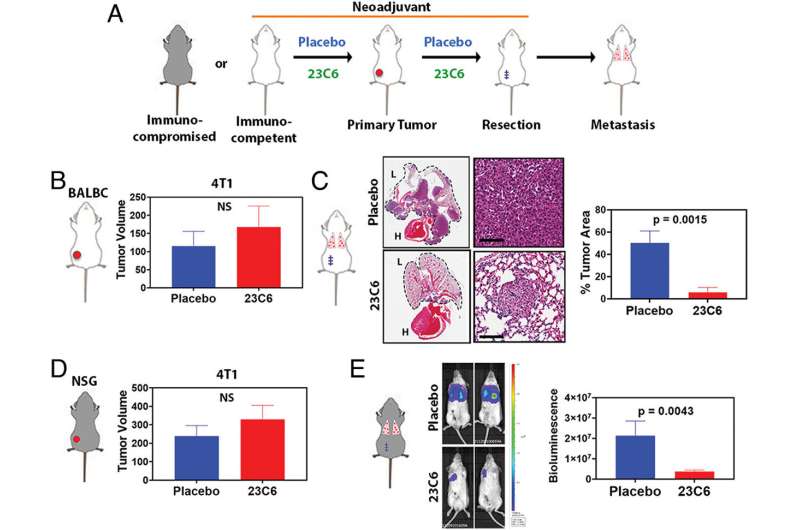
一种抗钙粘蛋白的抗体(称为23C6)有效地抑制了胰腺癌和三阴性乳腺癌小鼠模型的血源性转移。23C6抗体识别两种不同的钙粘蛋白,它们通常表达在不同类型的ctc上。尽管它对单个细胞在循环过程中,抗体不会抑制肿瘤的形成,也不会在正常器官中引起可检测到的毒性,其中钙粘蛋白可能位于连接细胞的结构中,因此无法与抗体结合。
MGH癌症中心创新临床副主任、哈佛医学院医学副教授David T. Ting医学博士说:“这种疗法可能更有效地靶向ctc,因为这些抗体可以更好地进入血液中的循环细胞,与周围的血细胞相比,对ctc具有高度特异性。”
这项研究提高了开发基于抗体的疗法以靶向ctc抑制血源性转移的可能性,血源性转移是癌症死亡的主要原因。Ting说:“虽然转移是实体瘤致命的主要来源,但目前还没有批准的治疗方法专门针对转移过程或导致癌症扩散的侵袭性细胞子集。”“结果表明,我们的方法可以有效地针对不同类型的ctc。随着更多的研究和开发,使用这种方法的疗法可以用来防止癌症扩散,提高长期生存率。”
进一步探索