研究人员ID位置大脑蛋白质与帕金森病的发展
约翰霍普金斯大学的医学研究人员称他们已经发现的α-突触核蛋白,大脑中的一种蛋白质,使其大脑细胞叫做神经元和可能推动帕金森病的发展,逐步恶化的疾病,破坏运动和神经功能。这些发现可以帮助科学家们开发一个治疗,抑制蛋白质的绑定,不当可能放缓或停止帕金森病的进展。
研究结果,进行使用和鼠标神经元细胞研究,已于6月25日,2021年美国国家科学院院刊》上。
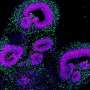
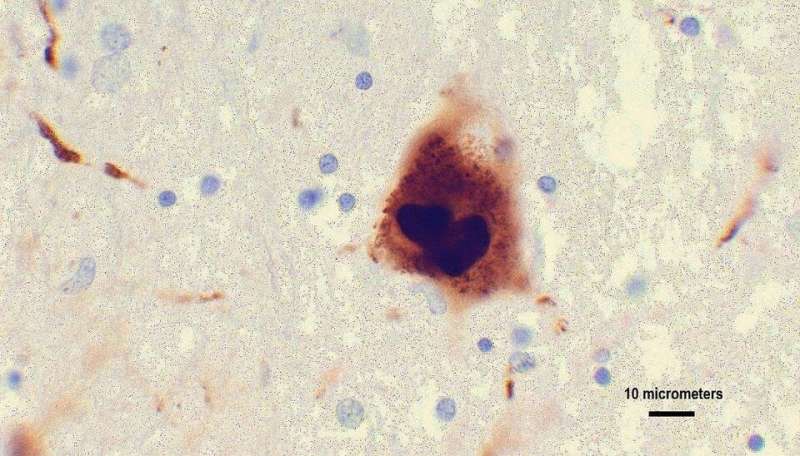
在帕金森病中,α-突触核蛋白蛋白质错误折叠和可以异常形状,使其能够绑定和丛到神经元的表面。共核蛋白的错误折叠,称为α-突触核蛋白原纤维,蔓延到其他健康的神经元并最终杀死这些细胞纤维堆积。
“这些发现意义重大,因为我们决定哪一部分的α-突触核蛋白原纤维绑定过程中是重要的,以及它如何导致帕金森病的进展,”毛说研究的合著者刘晓波,博士,神经病学助理教授细胞工程研究所的约翰·霍普金斯大学医学院的。
通过一些分子和细胞研究,该研究小组专注于一个地区的提示错误折叠α-突触核蛋白原纤维称为C末端,连同p129,附近的一个化工集团原纤维。研究人员从先前的研究中得知,这两个特点使纤维结合神经元,导致细胞死亡。
约翰霍普金斯医学毛泽东和他的同事研究的合著者和帕金森病研究员Ted道森,医学博士博士,谁是细胞工程研究所的主任和神经学教授约翰·霍普金斯大学医学学院的C末端可以绑定受体神经元由于受体的积极的电荷。受体被移除时,C末端不能丛神经元和扩散到其他健康的细胞。
在健康的α-突触核蛋白,C末端覆盖,不能绑定到神经元。
研究人员还调查了p129,一群分子α-突触核蛋白原纤维有一个额外的化工集团,并在大约95%的人与帕金森症和其他路易的身体神经退行性疾病,比如路易体痴呆。当α-突触核蛋白原纤维p129和C末端注入小鼠神经元,研究人员发现,那些原纤维结合神经元受体和传播得更快。这导致更快的细胞死亡和疾病进展。
慢形成α-突触核蛋白原纤维的进展,研究者希望能够开发出一种治疗目标绑定过程。
“如果α-突触核蛋白原纤维的传播可以被阻止C末端绑定,这将是一个不错的治疗策略,”毛说。
进一步探索