核糖核酸疫苗对COVID-19变异提供保护做什么?
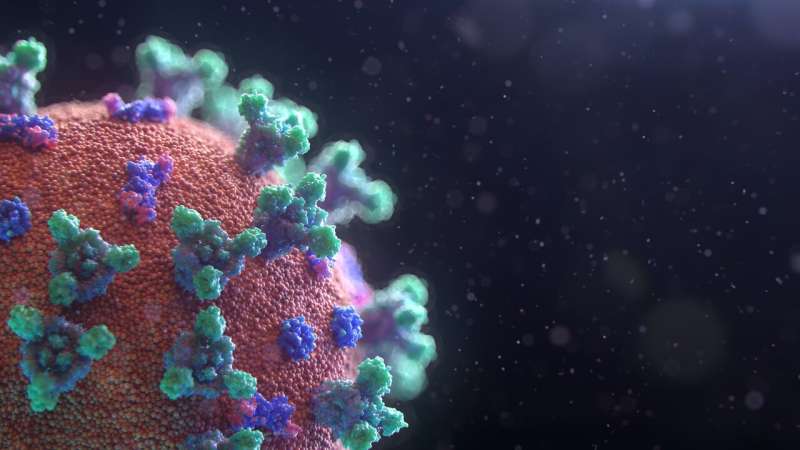
自从SARS-CoV-2变异的样子,心中都是一个至关重要的问题:将疫苗来防止“原始”开发的压力也对新变体?
这是一个合法的担忧。3月下旬,南非宣布出售其所有剂量的AstraZeneva疫苗后的研究显示这是更有效的对变体主导世界的一部分(20 h / 501 y。V2, B.1.351血统)。
开创性的核糖核酸疫苗呢?研究人员一直试图找出答案。一个文章发表在杂志上细胞表明一些变异能够逃脱中和了免疫反应从先前的感染,是否获得了“原始”SARS-CoV-2应变,或从接种疫苗。
尽管这些研究证明持续警惕的重要性,下结论还为时过早,潜在的临床意义。让我们仔细看看。
当一个病毒疫苗“逃”的回应
当环境条件最优(合适的温度,丰富的食物等),微生物如细菌和病毒可以用指数,产生令人眼花缭乱的拷贝数。在这个过程中,mistakes-also称为变异。有些是中立的,既不帮助也不伤害微生物。别人是有害的,导致微生物死亡。还有人优惠,给微生物对那些没有突变一定的优势。
不同种类的优势exist-ability养活一个新的资源,新的防御机制,抵抗新的环境条件等。由某些细菌抗药性的产生来自于这些“有益的”突变。另一个例子是逃离疫苗反应,它允许传染性微生物仍不受免疫反应旨在消除它们。
为了研究病毒的传染性,而不必处理这些危险的微生物,病毒学家开发了准型逆转录病毒粒子。这些工具作为“假”粒子只包含基因在病毒囊膜病毒的问题。这是我们能找到“钥匙”,允许它感染病毒进入细胞(峰值或者S蛋白的SARS-CoV-2冠状病毒)。
这些基因,研究人员增加另一个产生荧光蛋白。这意味着,如果pseudovirus成功进入靶细胞,他们会发出荧光,使他们更容易观察。
这个工具已经允许我们研究中,例如,一些条目丙型肝炎病毒在肝细胞的机制。它也常用于演示有多少耐心抗体阻止病毒进入。如果他们是“中和”,这意味着抗体成功阻止病毒进入细胞使用的蛋白质之间的相互作用和相应的受体,或称为“锁”,位于细胞表面。在这些情况下,病毒是堵在门口,可以这么说。
美国、德国和南非的研究人员用这种方法来研究血清从接种疫苗的个人的能力中和SARS-CoV-2峰值蛋白质。这就是他们的研究显示。
突变允许逃避免疫应答
作者关注的是两个信使核糖核酸疫苗,即Pfizer-BioNTech疫苗(Cominarty品牌名称,使用的主要疫苗在法国,代表第一剂量的65.4%)和现代化疫苗(少数,7.7%的第一剂量)。他们收集了99名接种疫苗的患者的血清样本在第一次和第二次注射,然后测试这些样品的中和能力原始年代蛋白质,蛋白质与D614G突变,所谓的“英国”和S蛋白变体(B.1.1.7血统),“南非”变体(B1.1.351血统)和“巴西”变体(P1血统)。
他们的研究结果表明,两种mRNA疫苗提供有效的保护病毒D614G变体和英国不同,尤其是后两个剂量。另一方面,患者抗体显示有限中和S蛋白的南非和巴西的变异,表明这些疫苗对这些变异可能不太有效。这似乎表明,少量的突变可能足以让SARS-CoV-2逃脱这些疫苗引发的免疫反应。
然而,这些结果对于人口的后果仍有待观察,也突出了作者自己。
保持警惕
尽管进行了高水平的严谨性,这不过是一个在体外研究中,这意味着结论不能这些结果的临床影响,从培养细胞。我们仍缺乏信息接种个人细胞免疫力,从而保护他们尽管缺乏体液免疫保护,即保护抗体。
有趣也可以研究血清的中和能力的人获得了阿斯利康或强生疫苗单剂疫苗已经可以在4月24日以来法国药房。它还可以帮助我们理解准型逆转录病毒粒子的能力基于所谓的“印度”的变体(20 / 484 q, B.1.617血统)为了逃避疫苗的效果。这将提供其潜在作用迹象,(仍在商榷)在印度目前流行病肆虐。
最后,这些结果将通过观测证实了在一般人群中,为了回答两个问题:接种疫苗的人可以感染了这些变异?如果是这样,他们发展成严重的感染,和在什么比例比未接种的人?
不过,这些新发展是让人放心,尤其是法国的局势似乎mRNA疫苗目前提供有效保护英国变体,目前大量循环。
然而,这项研究强调采取一切必要的预防措施来监控的重要性,如果可能,限制南非和巴西变种的传播,应该少mRNA疫苗被证明是有效的对这些变异体内。限制人们从地区这些变异是循环是不幸的是合理的,为了避免另一波大流行。
进一步探索














用户评论