解锁骨骼老化背后的神秘
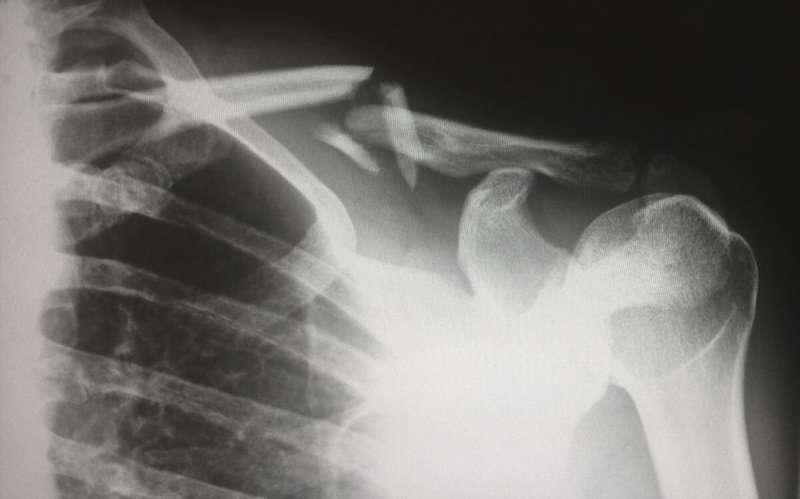
加州大学洛杉矶分校牙科学院的研究人员已经确认了一种关键酶在骨骼老化和骨质流失中扮演的角色,这使他们更接近于了解导致骨质疏松症的复杂生物机制。骨质疏松症是一种折磨着全球约2亿人的骨病。
他们在小鼠的研究结果,今天在线发表在线细胞干细胞他们说,美国和美国的骨质疏松症可能是研发更有效的骨质疏松治疗方法和改善老龄化人口生活的重要关键。
细胞在骨髓被称为间充质干细胞作为人体骨骼组织的组成部分,但是这些干细胞最终发展成骨或者脂肪组织部分被称为调节基因,沉默一些并激活其他分子的表观遗传因素分子来控制。
加州大学洛杉矶分校的研究人员在著名教授、牙科学院口腔生物学主任王存玉博士的带领下,证明了当表观遗传因子KDM4B在间充质干细胞中缺失时细胞,这些细胞更可能分化为脂肪细胞而不是骨细胞,导致一种不健康的不平衡,使骨骼衰老加剧并导致脆弱的骨骼和骨折随着时间的推移。
“我们知道骨质损失该研究的通讯作者、加州大学洛杉矶分校牙科教授朴诺熙博士说:“随着年龄的增长,但直到最近,骨质疏松症等极端病例背后的机制一直非常模糊。”“在这项研究中,我们建立在我的博士后学者、首席作者邓鹏博士7年多的研究基础上,希望我们最终能够防止骨骼老化和骨质疏松症。”
虽然科学家们很早就了解了参与骨组织形成的细胞途径,但表观遗传因素的作用却并不明确。Wang, Deng等人之前的研究已经确定KDM4B酶在骨形成中起着重要的表观遗传作用,但他们不确定它的缺失会如何影响骨形成和骨丢失的过程。
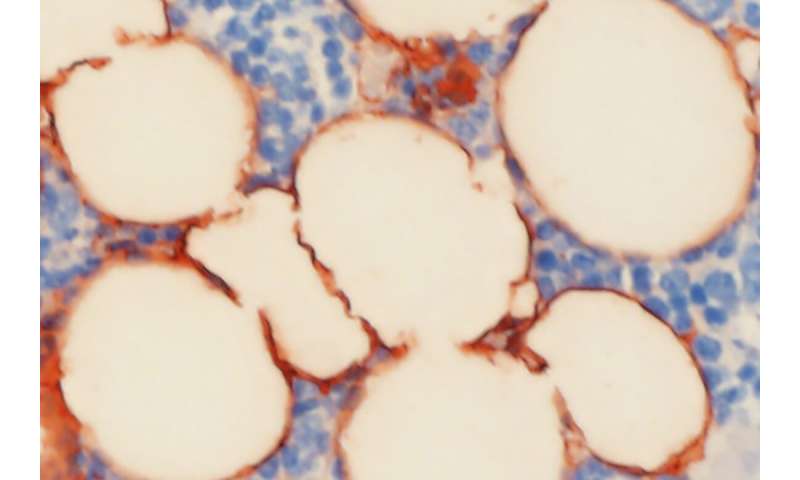
为了测试这一点,研究团队创建了一种鼠标模型,其中kdm4b在几种不同的场景中缺席或删除。他们发现,去除酶推动间充质干细胞以产生更多的脂肪而不是骨组织,导致骨质损失随时间,模仿骨骼衰老。
在一个重要的场景中,科学家检查了干细胞衰老,或恶化和疲惫 - 间充质干细胞停止恢复活化或随时间创造更多的自然过程。该团队意外地发现,导致自然骨骼衰老的衰老以KDM4B的丧失为特征。
除了年龄,其他环境因素被认为降低骨质量和加剧骨流失,包括高脂肪饮食。研究小组证明,KDM4B的缺失显著促进了高脂饮食小鼠的骨质流失和骨髓脂肪的积累。
最后,该团队发现甲状旁腺激素,一种被美国食品和药物管理局批准用于治疗衰老相关骨丢失的合成代谢药物,以kdm4b依赖的方式帮助维持衰老小鼠间充质干细胞池。
结果不仅确认关键作用KDM4B在间充质干细胞命运决策中,骨骼床衰老和骨质疏松症,但它们表明KDM4B的丧失在许多条件下加剧了骨质损失,并且令人惊讶的是,KDM4B控制间充质茎的能力细胞自我更新。本研究是第一个体内研究,以证明表观遗传因素的丧失促进成人干细胞衰落和骨骼衰老。
研究人员所说的调查结果,持有最终开发逆转骨脂肪不平衡的策略,以及通过恢复活化干细胞解决骨骼床和骨质疏松症的新预防和治疗方法。
“王博士、他的实验室成员和合作者的工作提供了与骨骼老化相关的变化的新的分子洞察,”加州大学洛杉矶分校牙科学院院长保罗·克雷布斯巴赫博士说。“这些发现是重要的一步,可能会导致更有效的治疗数百万遭受骨质流失和骨质疏松症的人。”
进一步探索








用户评论