研究人员确认了一种致命脑癌的起源
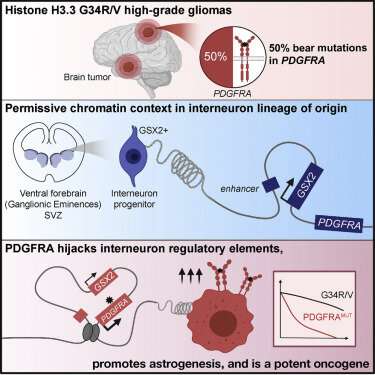
麦吉尔大学的研究人员希望鉴定肿瘤生长所需的原产地和特定基因可能导致新的治疗方法治疗青少年和年轻成年人的致命脑癌。该发现涉及胶质母细胞瘤的亚组,罕见但积极的癌症形式,通常在发病三年内证明致命。调查结果发表于最新期刊细胞。
为了完成他们的研究,研究小组由麦吉尔大学的儿科和人类遗传学教授纳达·贾巴多博士和克劳迪娅·克莱恩曼博士领导ob体育开户网址人类遗传学,为该胶质母细胞瘤的亚组组装了最大的样品集合,并在称为PDGFRA的基因中发现了新的癌症突变,驱动细胞分裂激活时的增长和增长。
研究人员注意到,近一半的确诊患者和绝大多数肿瘤复发患者在该基因中有突变,该基因在胶质母细胞瘤亚组中也异常高表达。“我们调查了儿童和成人患者的大型公共数据集,以及实验室中从患者样本中生成的数据集,得出了相同的结论,即PDGFRA在这些肿瘤中过度激活。这让我们怀疑该激酶在肿瘤形成中起着重要作用。”贾巴多实验室的候选人和这项研究的共同第一作者。
使用他们的团队产生的“大数据”资源使用衡量数千个中每个基因的水平的新技术单个细胞,他们能够发现这个大脑肿瘤起源于特定类型的神经元干细胞。“我们使用单细胞分析来创建健康发展大脑的地图,识别数百个细胞类型及其特征,”梅林·杰萨解释说,博士学位解释说:梅林·杰萨解释道在Kleinman Lab和Co-First作者的学生在这项研究中。“由于这些脑肿瘤保留了它们起源的细胞的记忆,或足迹,然后我们可以针对在地图集的这些肿瘤中确定最相似的细胞类型,在这种情况下,抑制胎儿发育期间出现的神经元祖细胞在发展大脑的具体结构中出生,“在犹太综合医院戴维斯夫人德华岛研究所领导了一个计算研究实验室。
一个意外的发现
研究人员指出,在这种神经元干细胞群中通常不会导致PDGFRA基因。“通过使用测序技术在3-D中测量细胞的DNA如何在空间组织的情况下,”Jabado实验室的博士后研究员Djihad Hadjadj和该研究的Co-First作者“,我们发现,在这种神经元干细胞中精致,DNA在3-D维度中具有独特的结构,允许PDGFRA基因被激活,在那里不应该是导致癌症。“
该发现在适当分类肿瘤时也很重要。“以前,这种肿瘤类型被归类为”胶质瘤“,因为在显微镜下,它类似于胶质细胞大脑中,一个主要的细胞类型,“Jabado博士说,他持有儿科肿瘤学CRC一级除了临床科学家蒙特利尔儿童医院和领导研究实验室专注于研究脑部肿瘤研究所的麦吉尔大学健康中心。“我们的研究表明,这是一件认错的事情。这些肿瘤实际上产生于神经元细胞,而不是神经胶质细胞。”
有治疗的希望
抑制PDGFRA活性的药物可以靶向PDGFRA,事实上,已经有批准的药物可以靶向PDGFRA治疗该基因突变导致的其他癌症,比如胃肠道间质肿瘤。研究人员指出,这为寻找针对这类致命脑瘤的靶向治疗方法提供了希望。
基因组的综合研究,包括在单细胞水平和肿瘤的三维基因组结构与正常发育的大脑的比较,是这项研究的关键。他们帮助确定了在发育过程中细胞易受这些“神经胶质瘤”的癌症驱动事件影响的特定时间点,这些“神经胶质瘤”被发现是神经肿瘤。重要的是,作者揭示了可能导致致命癌症靶向治疗的基因事件。“我们的发现为在不久的将来改善对这种肿瘤实体的治疗提供了希望,因为这些微妙的弱点可能定位于优先攻击‘坏’细胞的治疗,”dr .说。贾巴多和克莱因曼,他们共同努力对抗致命的脑瘤。发育停滞是许多癌症的根源。同样的策略将被证明是重要的,以揭示起源,识别和利用特定的弱点,并为未来的策略,以早期检测其他影响儿童和年轻人的脑肿瘤实体。”
进一步探索










用户评论