新的生物标志物预防干细胞移植在发现的嫁接腹膜疾病
最近发表的报告科学翻译医学通过MUSC Hollings Cancer Center investigator Sophie Paczesny, M.D., Ph.D., sheds light on immune cell biomarkers that may reveal which patients are most at risk for graft-versus-host disease (GVHD), a life-threatening condition that can arise after hematopoietic stem cell transplantation (HSCT) for treatment of liquid cancers such as leukemia.
“同种异体的HSCT仍然是治愈白血病的唯一经过验证的治疗方法,”Musc微生物学和免疫学系的主席Paczesny解释说。“在HSCT中,供体匹配的细胞被注入病人的血液中并最终进入骨髓。这些细胞中的一些是免疫细胞,这有助于消除未被化疗杀死的残留白血病细胞。然而,尽管仔细捐赠者 - 受援者匹配在移植后使用免疫抑制疗法,一些供体的免疫细胞可能开始攻击患者的组织,这些组织称为移植物与宿主疾病。“
GVHD可影响50%接受造血干细胞移植的患者,并可表现在多个器官。大约三分之一的GVHD患者经历了胃肠道内的局部效应(GI-GVHD),这是致命的最高风险。
PACZESNY进一步描述了这种现象。“对于白血病患者,您提供与受体相比具有不同生物或抗原,签名的供体细胞。这些免疫细胞如何识别白血病并破坏它。然而,这些抗原也存在于正常组织中,特别是在身体的区域,与肠道一样,如肠道。所以这就是供体免疫细胞的发作和症状最难治疗的地方。“
生物标记故事
骨髓衍生干细胞被称为多能,这意味着它们可以成熟到许多不同类型的细胞中。这包括红色和白细胞以及其他免疫细胞类型如树突细胞和负责平衡免疫和耐受性的T细胞。
树突状细胞通过在细胞表面上显示短蛋白链,称为抗原的短蛋白链交换与T细胞的消息。当它们识别“非自我”抗原时变得激活的T细胞,然后在触发身体对抗外部侵略者的情况下发挥关键作用,这些防御系统可以包括来自不同宿主的移植细胞的外来侵略者。
Paczesny实验室先前的工作表明,GI-GVHD中的免疫细胞信号通路增加了这些患者血液中“超活化”的致病性t细胞(Th17细胞)的数量。与缺乏移植物抗宿主病或皮肤中轻度移植物抗宿主病的患者相比,这些侵袭性t细胞的存在与较低的生存率相关。这些细胞在被称为ICOS的t细胞信号受体诱导的能力上也是独一无二的,ICOS是“可诱导t细胞共刺激因子”的缩写。
“这开始作为生物标记故事,”Paczesny说。“我们正试图了解这些T细胞的激活来源的地方。抗原呈现细胞的是什么?如果您在T细胞侧有ICOS信号的标记,则应有一个ICOS配体在抗原呈现的某处细胞在同一伙伴队的患者中。“
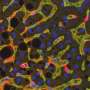
因为ICOS配体位于抗原呈递细胞的表面上,例如树突细胞,所以可以使用流式细胞术的现有技术容易地检测,其可以扫描血液中细胞上的这些外部标记。通过这种方式,可能会潜在标记在HSCT之后积极发展GI-GVHD症状的人。
Paczesny的小组表明,与对照相比,在GI-GVHD患者中增加了表达ICOS配体的树突状细胞(特别是称为血浆骨质树突细胞的群体)。批判性地,与具有低水平的人相比,这些细胞高水平的患者显着降低了三年的存活结果。
Djamilatou Adom,Ph.D.是与PACZESNY一起使用的博士后同伴,进一步探索了使用小鼠在GI-GVHD中的ICOS信号传导的作用。首先,他们表明,在将它们移植到接受者小鼠之前,在移植到受体小鼠之前,在供体小鼠骨髓细胞中产生的遗传消除免受来自GVHD相关死亡的受体小鼠。此外,使用具有非功能性免疫系统的“人源化”小鼠,研究人员发现将人ICOS配体表达血浆树突状细胞移植到这些小鼠中(其自身骨髓已被辐射销毁)导致GVHD随着肠内的含量增加。
浆细胞样树突状细胞参与GVHD是一个有趣的发现,Paczesny说。“如果这些细胞没有受到刺激,它们通常被认为更具有耐受性。换句话说,他们是好人。它们减轻了GVHD的严重程度。然而,如果它们激活t细胞——例如ICOS配体是通过与ICOS结合激活t细胞的因素之一——那么它们就会变得更具毒性,并可能推动GVHD的发展。这一点以前在该领域一直有争议;然而,过去的研究只研究了这些患者的浆细胞样树突状细胞的总数,而没有研究这些细胞的激活状态。”
GVHD中的一个新的药物靶点
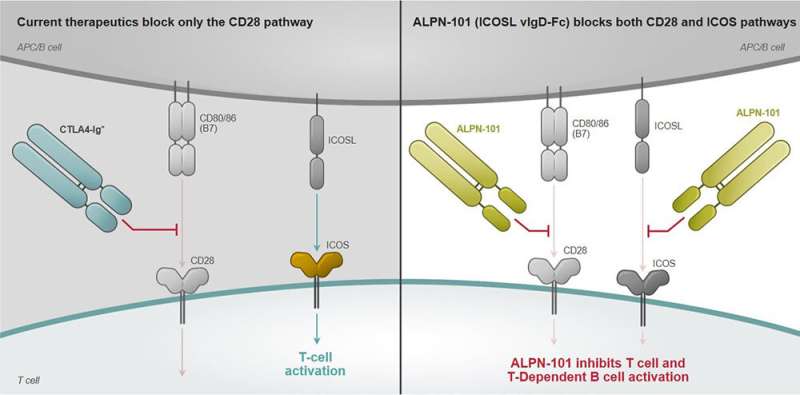
接下来,PACZESNY探索了靶向细胞对细胞ICOSL-ICOS信号传导,可以防止GI-GVHD。CD28 / B7共刺激途径诱导古典T细胞活化,同时通过T细胞受体识别外来抗原。CD28 / B7Pathway可以被目前批准的药物Abatacept和Belatacept中断(图1)中断。但是,通过尚未充分理解的机制,免疫细胞可以通过重新路由或通过替代性共鸣途径(如ICOS / ICOSL)进行激活来逃避CD28 / B7路径封锁。
与华盛顿州西雅图的高山免疫科学研究人员合作,PACZESNY的团队发现,用药物候选ALPN-101的给药小鼠,一种结合和阻断ICOS和CD28的重组人FC融合分子细胞,赋予GVHD的完全保护,同时也保持移植的抗肿瘤作用。它还比靶向CD28(BelataCept)或ICOS途径单独的药物更好。
“这是我第一次看到一种药物在治疗GVHD的同时,也保留了HSCT的抗白血病活性。这是新的,”Paczesny解释道。“同样有趣的是,当我们在移植后的早期直接提供这种药物时,以及当我们在疾病已经形成之后作为后期治疗提供它时,这种药物都是有效的。”这很重要,因为大多数时候移植物抗宿主病症状出现得晚得多,而这正是我们需要干预的时候。”
ALPN-101的临床试验已经开始,Paczesny希望她的生物标志物研究将为GVHD和其他免疫相关疾病(如狼疮)的治疗打开大门。这项研究得到了美国国家癌症研究所(National Cancer Institute)超过150万美元的资助。
“近期移植数量有一个大的跳跃,因为临床医生改善了他们的HSCT技术并扩大了其应用。现在还有更加对减轻同种异体反应的需求,因为第三方捐赠者的细胞疗法也在扩大。因此,GVHD将继续成为一个问题。但现在,我们有一个生物标志物,当它提升时,将有助于我们何时开始专门针对目标。“











用户评论