为什么α-突触核蛋白聚集体的结构差异导致不同病理学?

通常可溶性蛋白质的错误折叠和聚集是许多神经变性疾病的常见病理特征,包括阿尔茨海默,帕金森,克雷兹菲尔特 - 雅各和亨廷顿的疾病。例如,帕金森病(Pd),具有石油体(DLB)和多种系统萎缩(MSA)的痴呆,其特征是通过神经元和/或神经胶质细胞中被错误α-突触核蛋白的积累,因此这些疾病被称为α突变蛋白化。在Pd和DLB中,α-突触核蛋白病理主要在lewy体和石油公司的神经元中观察到,而MSA中的oligodendrocytes中可以观察到胶质细胞质夹杂物。
以前的研究表明,α突触核蛋白具有朊病毒,种子依赖性聚集,细胞对细胞繁殖的性质以及不同的聚集体构象(菌株)的存在性。朊病毒疾病的蛋白质聚合物和临床表型之间存在关系,但是,α突触核蛋白聚集体的菌株差异是否仍然不清楚。在本研究中,TMIMS的铃木和同事阐明了可能的分子机制,以考虑不同α突触核蛋白菌株诱导的不同病理学。
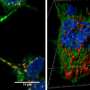
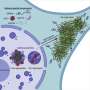
首先,Suzuki和他的同事制备了重组α-synuclein单体,在有盐或没有盐的生理浓度下搅拌,从相同的单体中产生两种类型的α-synuclein原纤维,α-synuclein原纤维(+)和α-synuclein原纤维(-)。接下来,他们将α-synuclein原纤维(+)和α-synuclein原纤维(-)注射到野生型小鼠的纹状体中,一个月后,他们检查了磷酸化α-synuclein沉积的积累,类似于在患者大脑中观察到的。他们发现α-synuclein原纤维(-)通过小鼠大脑诱导了路易体/路易神经元样异常磷酸化α-synuclein沉积,而α-synuclein原纤维(+)诱导很少磷酸化α-synuclein沉积(图)。
为了进一步研究神经元,铃木和同事中病理α-突触核蛋白聚集体的形成差异,将两种α-突触核蛋白菌株诱导原发性小鼠皮质神经元中α-突触核蛋白的种子依赖性聚集的能力。他们观察到磷酸化α-突触核蛋白积累的显着增加,这对于遍在蛋白也是阳性的,只有在α-突触核蛋白原纤维( - )的情况下,虽然用α突触核蛋白原纤维(+)看到少量积累。他们还发现,不仅普遍存在的α-突触核蛋白,而且还占据了用α-突触核蛋白原纤维( - )处理的细胞中累积的其他泛素蛋白质,而用α-突触核蛋白原纤蛋白(+)。
铃木和同事检查了蛋白酶体在这两种类型的α-synuclein原纤维存在的活性,并发现只有α-synuclein原纤维(-)在体外明显抑制蛋白酶体的活性。他们还研究了26S蛋白酶体与原纤维的相互作用,发现α-synuclein原纤维(-)与纯化的26S蛋白酶体复合物共沉淀。这些结果表明,只有α synuclein原纤维(-)与26S蛋白酶体相互作用,从而降低蛋白酶体活性。
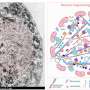
接下来,铃木和同事希望阐明两种类型的α-突触核蛋白原纤维的结构差异。他们调查了这些α-突触核蛋白原纤维的核心区和暴露的区域,发现α-突触核蛋白原纤维( - )具有较小的芯地区而α-synuclein原纤维(+)有一个更大的核心区域,延伸到c端区域。这表明α-synuclein原纤维(-)比α-synuclein原纤维(+)具有淀粉样结构,其c端区域更暴露。因此,他们认为α-synuclein原纤维(-)的c端区域可能与26S蛋白酶体相互作用并削弱其活性。
为了证实这一假说,Suzuki和他的同事们下一步研究了播散活性以及在没有盐的情况下形成的c端截短的α-突触核蛋白原纤维的蛋白酶体活性。他们制备了C端20个残基截断的α-synuclein单体(残基1-120),并在没有盐的情况下搅拌。α s δ c20原纤维(-)显示纤维形态,然后用α s δ c20原纤维(-)处理小鼠初级皮质神经元,只发现少量磷酸化α-突触核蛋白和泛素化蛋白的积累。此外,26S蛋白酶体的催化活性没有受到α s δ c20原纤维(-)的影响,而且α s δ c20原纤维(-)没有与26S蛋白酶体共沉淀。综上所述,α-synuclein的c端区域仅暴露在α-synuclein原纤维(-)中,该区域与26S蛋白酶体相互作用并削弱其活性。
α-synuclein的c端区域(96-140残基)是酸性的,含有带负电荷的残基,包括天冬氨酸和谷氨酸,以及脯氨酸残基。当c端区域的分子间斥力因离子强度的变化而减弱时,c端区域的暴露减少,在盐的存在下形成更紧密的α-突触核蛋白原纤维。另一方面,在没有盐的情况下,c端区域的分子间斥力导致α-synuclein原纤维的形成,其中c端区域暴露在外(图)。只有后一种类型的α-突触核蛋白原纤维能在体外与26S蛋白酶体复合物相互作用,从而抑制26S蛋白酶体活性。如果这也发生在细胞或大脑中,异常的α synuclein聚集物可能会被蛋白酶体部分降解。
根据朊病毒假说,疾病症状和病变的差异是由于菌株的构象不同造成的。因此,如果α-synuclein是朊病毒样的,不同的α-synuclein聚集物的结构可能导致不同的α-synuclein疾病所观察到的病变的差异。在本研究中,Suzuki和他的同事证实了两种不同结构的α-synuclein菌株导致了不同的病理,他们还发现这些α-synuclein菌株抑制26S蛋白酶体活性的能力也不同。这是一个值得注意的发现,由相同的单体在不同条件下形成的两种不同结构的原纤维中的一种可以抑制蛋白酶体,而另一种则没有。这显然增加了异常α-突触核蛋白抑制蛋白酶体的可能性,在病理中发挥作用。
这些结果为解释不同的α-突触核蛋白菌株诱导的不同损伤提供了可能的分子机制。考虑到PD和MSA积累α-突触核蛋白的结构不同,似乎α-突触核蛋白原纤维的结构决定了这些疾病的病变。












用户评论