臭名昭着的癌症蛋白质突变与增殖疾病合作
了解癌症进展中发生的基因突变和蛋白质变化是其治疗的关键。基因中的突变TP53在癌细胞中伴随突变体P53蛋白在多种不同类型癌症的多种研究过程中变得臭名昭着。然而到目前为止,这些蛋白质繁殖繁殖疾病的作用的机制已经理解得很差。在Kanazawa大学的Masanobu Oshima及其合作者现在举报结果表明,这些蛋白质的变化可能导致加速肿瘤引发和转移。
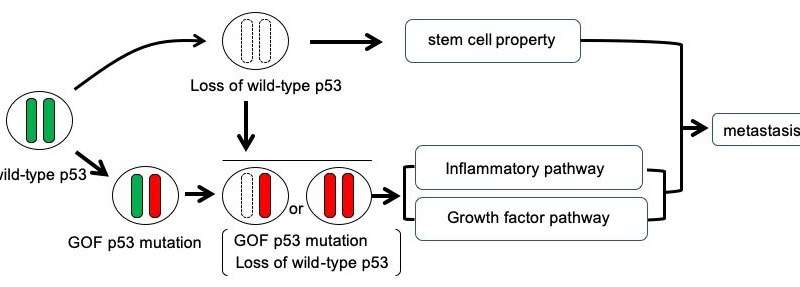
以前的癌症,肠和胰腺癌的研究以及结直肠癌癌症据表明,P53的变化导致侵入能力和干细胞特征至关重要的晚期肿瘤瘤。除了这种“功能的增益”(GOF)'突变之外,野生型蛋白P53减少了癌症细胞通过“杂合性的损失”过程,而不是对每个父母对应的每个基因具有两个等位基因,而基因只有一个。
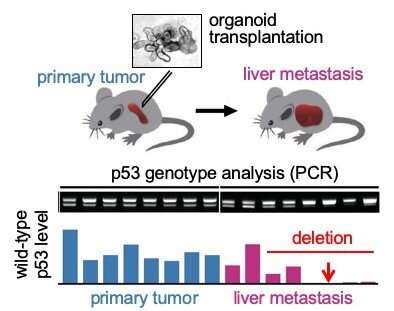
大岛渚与日本金泽大学、Theragen Etex生物研究所和韩国首尔国立大学的研究人员合作。他们发现,肿瘤细胞携带GOF突变体P53并丧失野生型P53富集在肝转移病变中,表明P53 LOH和GOF突变的组合促进转移。在彼此分开的单细胞的研究中,研究人员发现,杂合子的丧失是细胞存活率和增殖的关键,这对转移具有影响。此外,形成的结构更复杂和腺体。
进一步的研究表明,功能突变的增益和杂合子丧失的组合提供了一些免受细胞死亡的保护。当注射在实时鼠标模型时,组合也加速了肿瘤引起的。形成的肿瘤具有纤维化的微环境,具有差的结肠直肠癌预后差的签名。
纤维化结构也与炎症途径有关。研究人员使用独创性路径分析软件包对突变蛋白进行了分析,该软件包提供了对基因表达和其他细胞性状的综合分析。分析表明生长因子/MAPK和炎症通路确实在功能突变获得和杂合性丢失的细胞中上调。更重要的是,曲美替尼治疗(抑制MAPK通路中的一种蛋白质)抑制了这些突变细胞的克隆效率。独创性途径分析还揭示了干细胞途径在获得功能突变和杂合性损失的细胞中被上调细胞两个Trp53等位基因都被破坏。在他们的报告中,研究人员建议他们的发现“将有助于未来针对结直肠癌转移的治疗策略的发展。”
进一步探索









用户评论