研究人员在干性AMD的眼睛中发现牙釉质蛋白质
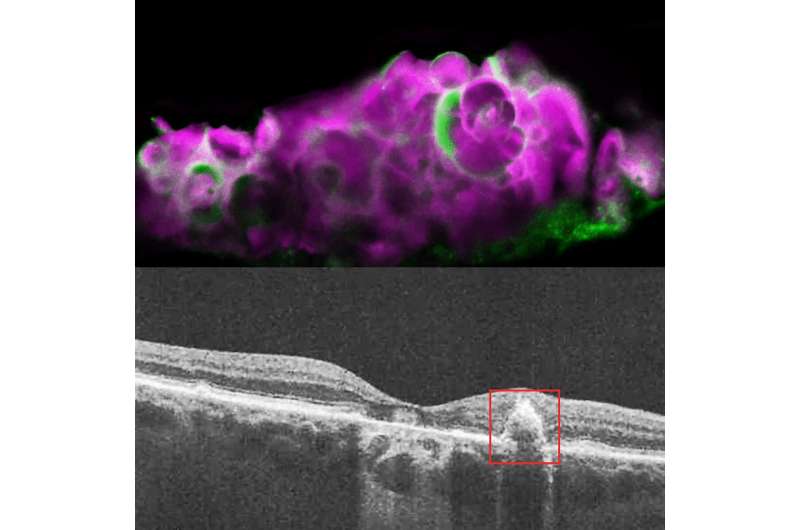
根据国家眼部研究所(NEI)的研究,常常沉积在牙釉质中矿物牙釉质中的矿物质钙的蛋白质中的蛋白质也可能负责钙沉积物中有干燥的年龄相关性黄斑(AMD)的钙沉积物。。这种蛋白质Amelotin可以成为致盲疾病的治疗靶标。调查结果发表在期刊上翻译研究。NEI是美国国立卫生研究院的一部分。
“用一个简单的视网膜色素细胞培养模型上皮细胞,我们能够表明Amelotin因某种应激而导致某种压力,并导致形成特定种类的钙矿床,也看到骨骼和牙齿。当我们用干燥的AMD看着人类捐赠者眼睛时,我们看到了同样的事情,“Graeme Wistow,Ph.D.的分子结构和功能基因组学的Nei Section,以及该研究的高级作者。
amd有两种形式——湿的和干的。虽然有治疗方法可以减缓湿性AMD的进展,但目前还没有治疗干性AMD(也称为地域性萎缩)的方法。在干性黄斑变性中,胆固醇、脂质、蛋白质和矿物质的沉积积聚在眼睛后部。其中一些沉积物被称为软性硬膜,具有特定的成分,不同于湿性AMD沉积物。Drusen形式下视网膜色素上皮(RPE),一层将营养物质从血管下面支持视网膜的光感光感受器。随着德鲁森的发展,RPE和最终感光体死亡,导致失明。感光感剂不能恢复,因此失明是永久性的。
最近,研究人员在干AMD沉积物中发现了一种名为羟基磷灰石(HAP)的含钙矿物化合物。羟基磷灰石是牙釉质和骨头。充满胆固醇的HAP小球,称为小球体,只在干性AMD患者的drusen中发现,而在湿性AMD或非AMD患者中没有发现。
在这项研究中,Wistow的团队发现,如果他们让RPE细胞在transwell(一种细胞培养系统)中生长9天,细胞就会开始沉积HAP。他们确定,AMTN基因编码的ameltin蛋白在长期饥饿后强烈上调,并在他们的细胞培养模型中负责HAP的矿化。在他们的RPE细胞系中阻断这一通路也阻断了这些drusen样沉积物的产生。
为了验证他们的细胞培养模型准确地代表干燥AMD,研究人员用干amd,湿amd,或没有amd检查人尸体眼睛。他们发现HAP和AMELOTIN只用干燥的AMD,而不是在其他眼中。虽然有时在没有博森的干燥AMD的区域发现AMELOTIN,但它主要存在于具有大沉积物的软德鲁森地区。
“在本研究之前,没有人真正知道羟基磷灰石如何在干燥的AMD Drusen中积累,”该研究的第一个作者迪努莎拉贾帕克斯说。“在眼睛中找到这种牙齿特异性蛋白质,这种蛋白质与羟基磷灰石沉积有关 - 这真的出乎意料。”
为什么干性AMD的RPE细胞开始沉积这些HAP小球体尚不清楚,但Wistow认为这可能是一种保护机制出错了。他说,这些蛋白质、脂质和矿物质沉积可能有助于受损的RPE细胞阻塞血管生长到视网膜中,是湿AMD的关键特征之一的问题。但是,当矿物沉积太广泛时,它们也可能阻止营养流向RPE和光感受器,导致视网膜细胞死亡。
“机械地,Amelotin看起来像形成这些非常特异的羟基磷灰石球的关键球员。这就是它在牙齿中所做的事情,这里它在眼睛的后面。概念上,你可以看到含有专门阻止的药物Amelotin在眼睛中的功能,这可能会延迟疾病的进展。但在我们尝试之前,我们不会知道,“Wistow说。
目前迫切需要试验干性AMD治疗药物的良好动物模型。基于这项研究的发现,Wistow和他的团队正在为这种疾病创建一个新的老鼠模型。此外,Wistow相信他的细胞培养模型,模仿干性AMD的特点,可能有助于高通量药物筛选,以找到减缓或阻止软髓的发展的分子。
进一步探索












用户评论