新型CRSD药物转化研究的数学建模突破
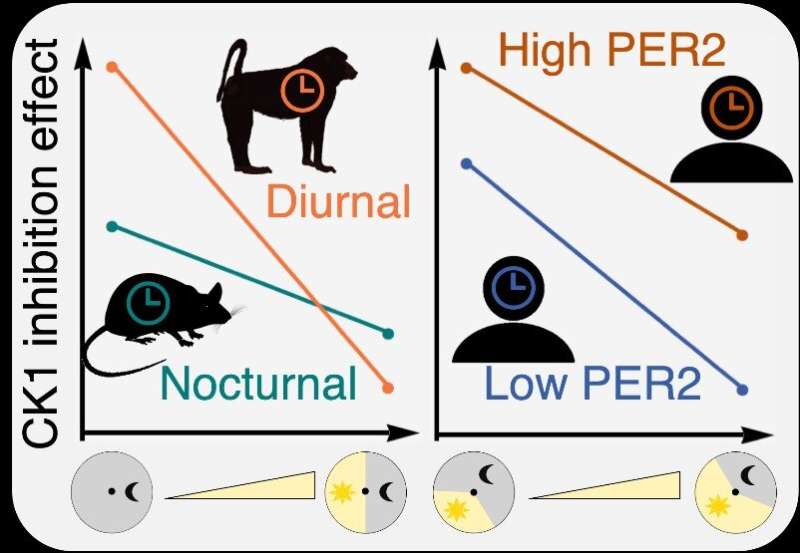
一种新的数学建模方法已经确定了一种时钟调节药物临床疗效的物种间和个体间差异的主要来源:光敏性和PER2水平。这使得昼夜节律紊乱的精准医学成为可能。
韩国科学技术院(KAIST)的金宰敬(音译,Jae Kyoung Kim)教授研究组与辉瑞制药公司(Pfizer)合作,将数学建模和仿真工具结合在一起昼夜节律睡眠障碍(CRSDs)分析辉瑞公司产生的动物数据。这项研究发表在分子系统生物学作为7月8日的封面文章
制药公司在动物身上进行了广泛的研究,以确定这种新药的候选资格。然而,动物试验的结果并不总是转化为同样的效果人体试验.此外,即使在人类之间,疗效因人而异,这取决于个人的基因和环境因素,这需要不同的治疗策略。
为了克服这些障碍,KAIST的数学家和他们的合作者开发了自适应时间疗法,以确定可以恢复正常的精确剂量方案昼夜在不同的条件下相。
昼夜节律是生物生理过程中的24小时循环,包括人类。人类大脑中下丘脑视交叉上核中的生物钟为睡眠等各种人类行为设定时间。
生活模式的改变导致的内源性计时系统的破坏,导致睡眠-觉醒周期的提前或延迟,睡眠-觉醒节律的不同步,导致crsd。为了恢复正常的睡眠时间,可以通过药物调节生物钟的时间。
辉瑞公司发现了一种物质PF-670462,它可以通过抑制生物钟的核心时钟激酶(CK1d/e)来调节生物钟的时间。然而,PF-670462在夜间活动的小鼠和白天活动的猴子之间的疗效有显著差异,两者的睡眠时间相反。
研究小组通过使用数学模型进行数千个虚拟实验,发现了这种药物反应的物种间差异的来源,该数学模型描述了时钟分子和PF-670462之间的生化相互作用。结果表明,PF-670462在白天活动的灵长类动物中比在夜间活动的小鼠中更容易受到光照的影响。这说明,要想利用PF-670462有效调节昼夜节律人的生物钟,必须考虑到光的强烈抵消作用。
此外,研究小组还通过虚拟患者发现了患者间药效差异的来源,这些患者的生物钟因各种突变而被打乱。内源性核心时钟分子PER2水平的扰动程度影响疗效。
这就解释了为什么生物钟调节药物的临床结果是高度可变的,并且某些亚型对治疗无反应。这指出了目前仅针对患者睡眠和苏醒时间的治疗策略的局限性,而没有针对睡眠障碍的分子原因。
第一作者、博士候选人金大旭(Dae Wook Kim)说,这激励了团队开发一种适应性的时间疗法该系统通过可穿戴设备跟踪患者的睡眠-起床时间,确定个性化的最佳每日给药时间,并实现了crsd的精确医疗方法。
Jae Kyoung Kim教授表示:“作为一名数学家,我很高兴能够帮助开发一种新的候选药物,它可以改善这么多患者的生活。我希望这一结果能促进翻译研究领域的更多合作。”
进一步探索














用户评论