儿童比成人癌症等的平均6.5年时间访问新药
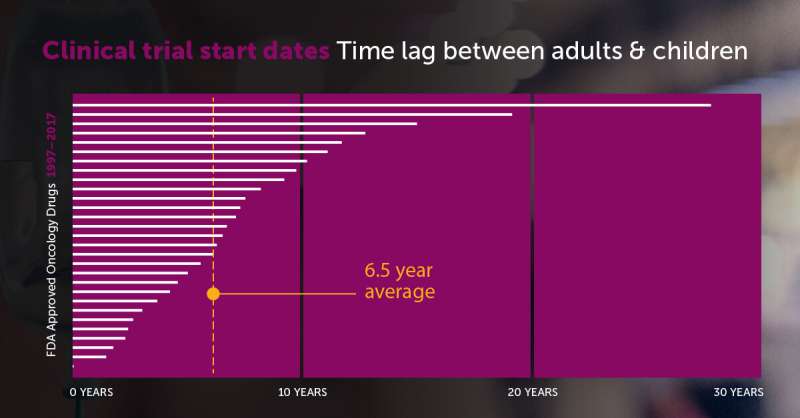
癌症药物经美国食品和药物管理局(FDA)的中值从6.5年的第一个临床试验在成人在孩子第一次审判,据一项研究dana - farber波士顿的儿童癌症和血液疾病中心。该研究结果发表在5月期的欧洲癌症杂志。
“尽管知道这些药物是有效的抗癌药物,它花费的时间太长甚至开始研究这些疗法孩子们史蒂文·g·杜布瓦说:“医学博士,波士顿丹娜-法伯/儿童癌症和血液疾病中心,这项研究的共同作者。“作为一个医生照顾年轻癌症患者,这是非常令人沮丧的。如果我是父母与癌症的孩子,我不会容忍这个。”
dana - farber波士顿儿童研究团队进行了系统分析,从先进-人体试验first-in-child试验代理第一FDA批准的任何肿瘤表明从1997年到2017年。研究人员利用临床试验注册表数据,出版文献和肿瘤学抽象识别相关试验和开始日期。
延迟儿科试验
在126年时间内,药物获得初始FDA批准肿瘤迹象。排除激素调节器(不是有关儿童癌症),117年代理仍然进行分析。15 117年药物(12.8%)尚未有一个儿科试验,尽管117年6药物(5.1%)包括孩子在最初的FDA的批准。

数据显示平均6.5年期first-in-human和first-in-child临床试验之间的滞后,范围从0到27.7年。
“有些人可能认为这种滞后是确保安全的一个脆弱的儿童适当的人口和代理只研究儿童在FDA批准,基于活动的成年人患癌症,”杜波依斯说。“其他人可能认为,这延迟太长对孩子和危及生命的疾病,一些代理失败在成人迹象可能不过是重要的药物儿科迹象。”
在美国,最近的比赛对儿童行为加强要求新的癌症疗法与潜在的生物相关性小儿癌症儿童的评估。本研究可以作为基准这项新政策颁布,杜布瓦说。
更多信息:迪伦诉奈尔et al,时机first-in-child试验肿瘤药物得到fda的批准,欧洲癌症杂志(2019)。DOI: 10.1016 / j.ejca.2019.02.011