升级工具箱杜兴肌营养不良研究与一个新的兔子模型
科学家依靠使用动物模型来改善我们对致命肌肉浪费疾病的理解Duchenne肌肉营养不良(DMD),并开发安全的新疗法。通过使用CRISPR / CAS-9基因组编辑创造的新开发的兔模型,与人类患者的临床相似性比目前正在使用的小鼠模型表现出更大的临床相似性,具有推进DMD研究的巨大潜力。
界定DMD的肌肉无力首先表现在4岁左右的受影响男孩的臀部和骨盆。这种与x有关的隐性疾病大约影响3500名男婴的出生,它是由一种名为抗肌营养不良的蛋白质产生的缺陷基因引起的,而这种蛋白质是保持肌肉纤维完整的关键。随着疾病的发展,肌肉会从上肢发展到上臂和肩膀,导致站立、爬楼梯和行走的难度增加。当男孩们进入青少年时期时,DMD也开始影响呼吸肌肉和心脏,这就意味着受影响的人在十几岁之后无法存活。医疗保健的改善意味着预期寿命增加,30岁出头甚至40岁出头的人越来越普遍。然而,目前还没有治愈的方法,目前的治疗主要是通过类固醇、物理疗法和矫形器械等药物来减缓和控制症状的发作,以改善活动能力。
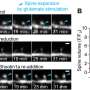
将靶向受影响基因的新基因治疗治疗允许生产某种水平的功能营养不良蛋白是开发的,并且已经可商购的药物数量少量。然而,可用的药物仅靶向导致DMD的不同肌营养不良蛋白基因突变的小百分比。对任何疾病的生理原因和新疗法测试的重要组成部分是使用动物模型。此前,绝大多数研究DMD已经在小鼠中进行,但尽管使用小鼠模型鉴定了大量潜在的治疗方法,小鼠与人类之间的生理差异意味着相对较少地被转化为成功的临床试验。狗模型比小鼠更好地复制人DMD,因为他们的生理学更为相似,并且DMD的猪模型也在开发中。然而,虽然大型动物模型具有巨大潜力,但增加了对DMD的理解和新疗法的发展,但它们的使用昂贵,仅限于世界各地的一些设施。填补可用于DMD研究的动物模型中的当前差距,在开放访问期刊上发布的新研究疾病模型和机制揭示了一个新的兔子模型,通过CRISPR/Cas9胚胎创建基因组编辑该研究由中国吉林大学和美国俄亥俄州立大学威斯纳医学中心的科学家团队共同完成。对于成功的DMD研究以及可能转化为临床前研究和人体临床试验至关重要的是,兔子表现出许多与DMD患者相同的肌肉萎缩的典型体征,包括严重受损的体力活动,升高的血清肌酸激酶水平,进行性肌肉损失和心肌损伤。
加速CRISPR / CAS9的发展
关键的发展动物模型是CRISPR / CAS9基因组编辑技术,彻底改变了现代生物医学研究的许多方面。ob欧宝直播nbaLead研究员Renzhi Han博士解释说:“虽然它过去两到三年来产生淘汰赛鼠标模型,现在有CRISPR / CAS9,它只需要几个月的时间来产生小鼠,大鼠,兔子等各种物种的淘汰赛模型,狗,猪甚至猴子。“在基因组编辑技术之前,涉及产生动物模型的方法,涉及关闭与人类疾病相关的整个基因。然而,在许多情况下,导致疾病的突变涉及对基因的微妙变化。这意味着疾病发病机制可能是对这些个体突变的特异性,并且可以通过关闭全基因来简单地模拟很好。具有CRISPR推导方法的精确核苷酸操作允许开发更准确地反映疾病突变的动物模型,并允许它们在更短的时间内开发。在最常用的DMD的小鼠模型中,在特定部位发生外显子23的中断导致蛋白质的破坏,导致蛋白质的损失。使用CRISPR / CAS9,汉族和同事博士能够专门针对不同的区域外显子51,这是人类基因中的常见突变“热点”。与更类似于人类的生理学配对,这意味着兔模型更加紧密复制人DMD的缺乏症缺乏。
推进寻求突破
展望未来,韩博士反映出来,“我们相信更好的模型将促进研究促进对DMD的理解并帮助发展新的疗法。”目前,科学家们致力于为肌营养不良制定新的治疗策略。他们最近的研究表明,CRISPR / CAS9基因组编辑治疗可以恢复营养不良小鼠中的营养不良蛋白表达和心脏功能。随着DMD兔的可用性模型,该团队计划与其他实验室合作,进一步了解这一和其他治疗策略的可行性,推动DMD研究的突破。














用户评论