新的基因疗法纠正一种形式的遗传性黄斑变性犬模型
宾夕法尼亚大学的研究人员开发了一种基因疗法,成功地治疗了一种犬类黄斑变性。这项工作为将研究结果转化为人类治疗一种遗传性疾病奠定了基础,这种疾病会导致中央视力逐渐丧失,目前无法治疗。
这项研究今天发表在美国国家科学院院刊该研究由宾夕法尼亚大学兽医学院的研究助理教授Karina E. Guziewicz和宾夕法尼亚大学佩雷尔曼医学院的眼科研究教授Artur V. Cideciyan领导。这项研究是宾大兽医学院和宾大医学院科学家长期合作的一部分,旨在推动基因和其他治疗致盲疾病的新疗法。
Cideciyan说:“在眼睛中,你有这两个完整的视网膜细胞层,它们相互迷惑,就像拉链一样,把你的视觉细胞和支持细胞交织在一起。”“这种疾病所做的基本上是将这些层拉开,而我们所做的是将它们重新拉开,将它们紧密地结合在一起。”
“通过这项研究,”Guziewicz说,“我们已经证明了存在一种治疗这是在一个大型动物模型上的工作。在进行了安全性研究之后,人体临床试验可能在不到两年的时间内进行。”
Guziewicz和Cideciyan的同事参与了这项工作,包括宾夕法尼亚兽医大学视网膜实验治疗部门的视觉科学家、医学遗传学和眼科学教授Gustavo D. Aguirre和眼科学教授William Beltran;以及宾夕法尼亚医学院眼科教授塞缪尔·g·雅各布森。
Best病,或黄斑变性,是一种由BEST1基因突变引起的遗传性致盲疾病。它通常表现在儿童和年轻人身上,逐渐剥夺他们的中心视力.
通过过去几年的各种研究,宾夕法尼亚大学的研究团队已经表明,狗也会患上一种惊人相似的疾病。2014年贝尔特兰领导的一项研究揭示,狗和人类一样,在视网膜的中心有一个小区域,密集地布满了锥状感光细胞——负责阅读、驾驶和感知细微细节的细胞——被称为中央凹。人类和狗的BEST1突变都损害了中央凹,导致视力丧失。
在成功治疗其他致盲疾病的基础上,该团队一直在开发一种治疗这种疾病的基因疗法。去年,Guziewicz和他的同事通过研究犬类模型,发现了导致疾病的潜在缺陷,即一种被称为视网膜色素上皮细胞(RPE)的支持结构无法与感光感光细胞紧密连接。这一发现为研究人员提供了他们所需要的结果衡量标准,以确定基因疗法是否有效。
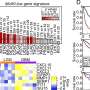
在最新发表的研究中,研究人员进一步研究了犬类的Best病,同时也检查了具有BEST1突变的人类患者,看看是否可以看到类似的缺陷。
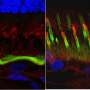
虽然已知贝斯特疾病和相关疾病会影响中央视力,但人们早就知道,这些疾病涉及整个视网膜的功能障碍。研究人员检查了疾病突变的狗的视网膜,发现了全视网膜的异常;RPE的内表面是与感光感光细胞沟通的关键,它无法正常发育,使感光细胞无法密切接触。当患病的狗只有6周大的时候,就可以很早就发现这一点。
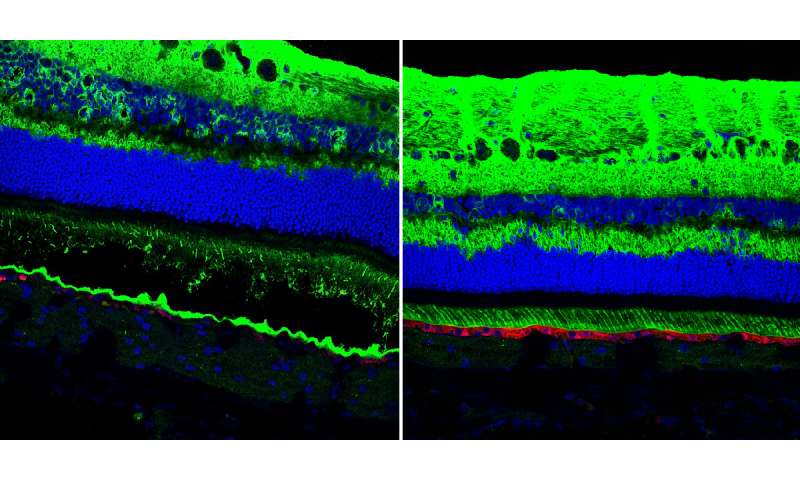
“这是出乎意料的,”Aguirre说,“这有助于解释这一令人困惑的疾病发现,虽然患者的病变是非常局部的,但当你做电生理测量时,你会看到视网膜范围的缺陷。现在我们可以看到RPE和光感受器之间的分离很早就发生了,我们知道这种疾病涉及视网膜的结构异常,先于光感受器细胞的损失。”
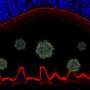
另一项发现是,在光照下对狗进行检查时,光照显著增加了rpe光感受器分离的严重程度。当狗回到黑暗中,分离减少。
目前尚不清楚这种与光线的联系是否存在于人类患者身上。但研究人员确实采取了一些措施,证明RPE和光感受器之间的类似分离正在影响视力。通过测量患者适应黑暗或获得“夜视”所需的时间,研究人员获得了营养物质在这两层膜之间扩散所需的时间细胞这是一个使黑暗适应成为可能的过程。他们表明,距离越远,营养物质的运输速度就越慢。
Cideciyan说:“这种营养的流动通常发生在非常小的距离内。”“所以如果这两层之间有分离,夜视的恢复速度就会减慢。这意味着,如果我们能纠正这两个组织的位置,我们也将纠正视觉缺陷。”
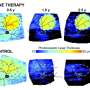
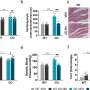
这就是研究人员在测试基因治疗结构时要做的事情。他们使用一种无害的病毒载体,将一种健康的BEST1基因拷贝,使用犬类或人类版本的该基因,注射到患有犬类Best疾病的狗体内,这些狗处于疾病早期和中期。
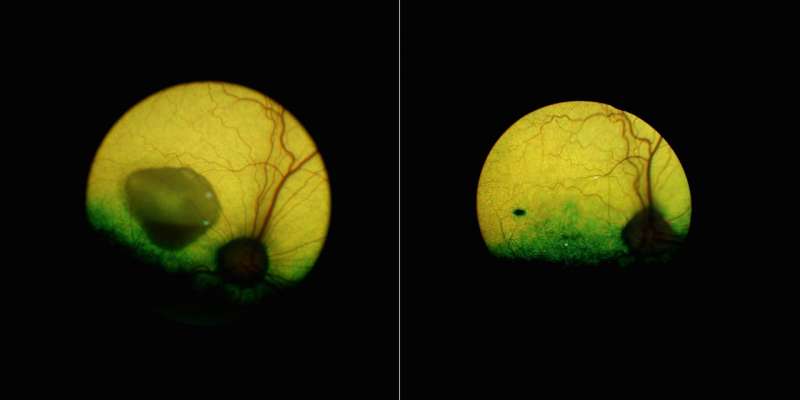
值得注意的是,他们能够纠正轻微和更严重的病变。仔细检查治疗犬的眼睛发现,基因治疗恢复了RPE和RPE之间的“拉链”结构感光细胞.为了确保他们的治疗能够纠正rpe -光感受器界面,他们将之前注射过的狗的眼睛暴露在光下基因治疗并发现在被治疗的视网膜区域没有发生rpe光感受器细胞分离。
Guziewicz说:“由于我们比以前更了解疾病的发病机制,这也使我们能够理解救援机制。”我们可以想象这些投影从以前从未存在过的RPE延伸;这是不可思议的。这恢复了这两个细胞层之间的适当位置。”
这种治疗似乎是持久的,因为接受治疗的狗的眼睛在长达五年的时间里都没有疾病。
在开始人体临床试验之前,仍有许多工作要做,包括确定哪些患者可能受益,评估疾病可能发展到何种程度而仍能得到有效治疗,并确保安全,以免损害患者仍然拥有的视力。但是,考虑到我们之间的关系狗概括人类疾病,研究人员希望这些发现能够转化。
雅各布森说:“在人类层面上,有很多家庭知道前几代人都患有这种疾病,年轻人生活在恐惧中,担心这种疾病是否会影响到他们。”“这揭示了一种以前无法治疗的幼年或遗传性疾病的机制和治疗方法黄斑变性这是向前迈出的一大步。”
进一步探索