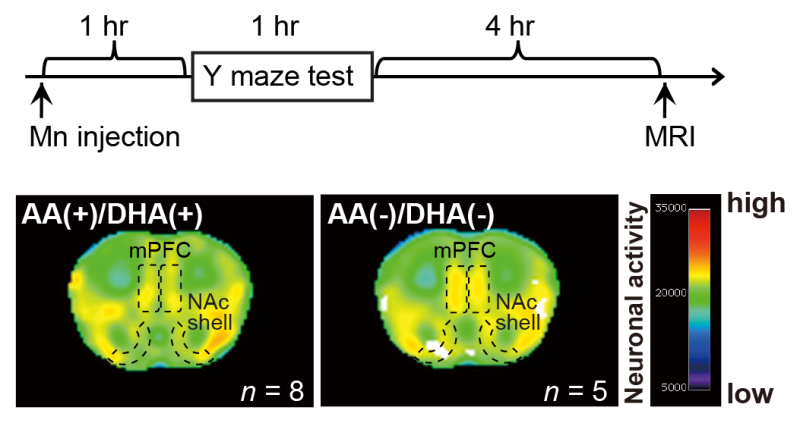
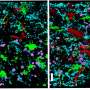
上面板:锰(Mn)增强磁共振成像(MRI)分析的时间安排。y迷宫试验后4小时(腹腔注射MnCl2后6小时)获得MRI信号。下图:AA/DHA小鼠内侧前额叶皮层(mPFC)和伏隔核(NAc)外壳的mn增强MRI信号强度明显大于AA(+)/DHA(+)小鼠。来源:日本
日本理研脑科学研究所(RIKEN Brain Science Institute)的研究人员发现,老鼠怀孕早期的营养变化会导致其后代成年后出现类似精神分裂症的症状。发表在翻译精神病学该研究表明,在早期妊娠期间,如何剥夺两种多不饱和脂肪酸可以通过基因表达的特异性表观遗传变化对后代的持久影响。
据称怀孕期间的有害条件会影响后代的健康,甚至导致成人发作疾病。这一概念 - 健康和疾病的发展起源(Dohad) - 解释为什么在饥荒后观察到精神分裂症的速度。为了开发对精神分裂症的有效治疗,Takeo Yoshikawa及其在Riken的团队正在研究早期发展中的营养不良程度如何变化大脑。
第一作者Motoko Maekawa指出,“我们的工作是在精神病学领域中第一次识别出DOHaD范式背景下营养环境与疾病风险之间的分子级联。”
搞清楚“如何”的第一步是确定最有可能与精神分裂症相关的营养缺乏。在几个与精神分裂症有关的候选者中,研究小组选择了两个具体的多不饱和脂肪酸-3脂肪酸DHA和-6脂肪酸aa -因为它们在大脑中含量丰富,并且已知与大脑发育有关。研究小组通过剥夺怀孕小鼠的DHA和AA来测试他们的理论,并测试它们的成年后代是否具有精神分裂症患者所表现出的特征。
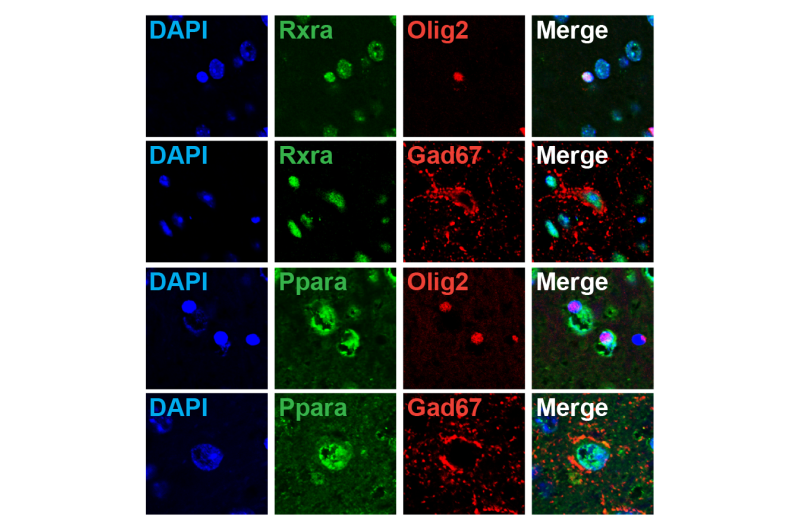
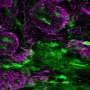
Immunohistological分析。关键核受体基因Rxra和Ppara在olig2阳性和gad67阳性细胞中表达。来源:日本
精神分裂症早期阶段的人有几种常见的症状,包括低水平的动机,抑郁,记忆受损,和大脑功能异常前额叶皮层。母亲被剥夺了DHA和AA的成年小鼠表现出类似的症状。
由于前额叶皮层中的功能障碍是精神分裂症的标志,该团队接下来研究了DHA / AA剥夺如何影响大脑的那部分中的基因表达。在数百人受影响中基因他们发现精神分裂症患者的一组基因下调,受影响的老鼠的一组基因也下调。这些基因与少突胶质细胞有关,少突胶质细胞是大脑中环绕神经元并帮助大脑信号传递的细胞。此外,影响GABA神经递质系统的基因表达也发生了改变,其方式与精神分裂症患者死后大脑的发现相似。
基因表达可以通过某种叫做核受体的蛋白质来控制,该蛋白质附着于DNA,并引发从DNA码中构建蛋白质的转录过程。当团队进行进一步分析脂肪酸被剥夺的小鼠时,他们发现已经下调了与脂肪酸有关的几种核受体基因。事实证明,少突胶质细胞相关基因的异常表达可以直接追溯到这些核受体的低表达,这又可以追溯到更高水平的DNA甲基化,一种调节基因表达的常见方法。通过这种方式,改变的饮食成功地创造了持久的变化基因表达。
一旦他们知道下调哪种核受体基因,该团队可以考虑如何扭转该过程。当他们赋予对小鼠作用于RXR核受体的药物时,它们发现上调少突相关基因,并且一些异常的电机行为减少。“这证明了作用于核受体的药物可以是精神分裂症的新疗法,”Maekawa说。
了解负责的基因也使团队成为患有精神分裂症的人的目标。两种单独的精神分裂症患者的毛囊分析表明它们也表现出降低表达相同的核受体基因。“下一步,”前川解释说,是测试针对这些核反应堆的药物的有效性受体患者的精神分裂症,并研究如何核受体调节少突胶质细胞和gaba能神经元的功能,以防止精神分裂症病理生理学的发展。”
更多信息:M Maekawa等人,神经发育过程中多不饱和脂肪酸缺乏通过核受体基因的表观遗传变化来模拟精神分裂症前驱状态,翻译精神病学(2017)。DOI:10.1038 / TP.2017.182
信息信息:翻译精神病学
所提供的riken.