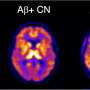
大脑中的肽复合物是阿尔茨海默症的罪魁祸首
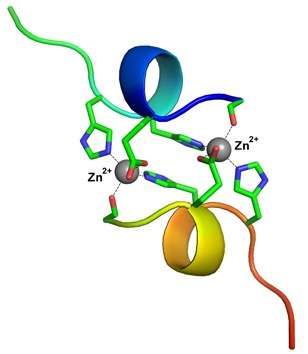
莫斯科国立大学罗蒙诺索夫基础医学院的成员确定了阿尔茨海默病早期阶段大脑中形成的肽复合物的结构。研究结果将有助于化合物的合理设计,以阻止疾病的发展。
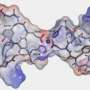
阿尔茨海默病与聚合淀粉样β肽在人脑中的含量。来自莫斯科国立罗蒙诺索夫大学的科学团队,在化学家Vladimir Polshakov的领导下,研究了致病家族性台湾突变的载体中β-淀粉样蛋白聚集的分子机制,并描述了新出现的复合物的结构,以确定其作用锌离子(锌2 +)。
β-淀粉样蛋白是一种具有重要生理功能的小肽,例如,保护大脑免受潜在致病物质的伤害。通常,肽完成其功能后被蛋白酶裂解并利用。然而,在某些情况下,这种肽分子开始相互结合,形成对神经元有毒的复合物。β-淀粉样蛋白聚集成这种复合物的过程是由过渡开始的金属离子.
几年来,来自莫斯科国立大学罗蒙诺索夫大学的科学家与来自Engelhardt分子生物学研究所的同事合作,研究了锌介导的β-淀粉样肽聚集的分子机制。他们选择了携带台湾突变的肽作为模型。阿尔茨海默病不可避免地在这种突变的携带者中在相对年轻的年龄发展。研究人员发现,由突变肽组成的β-淀粉样蛋白复合物的结构比来自天然肽的复合物更紧密、更稳定。锌离子(Zn)2 +)在它们的形成过程中起着关键作用。
Vladimir Polshakov评论道:“我们惊讶地发现,这种肽片段和锌离子之间的相互作用导致了稳定的形成复杂的,其中两个肽链被两个锌离子紧紧固定。类似的双核结构在文献中还没有描述过。特别是金属离子与β;-淀粉样蛋白的相互作用肽通常会导致多种肽链构象。新出现的复合物有点像“呼吸”,从一种构象传递到另一种构象。但在肽的情况下,我们只观察到一个构象,这使我们可以用核磁共振波谱法高精度地确定其结构。”
获得的结果将有助于合成能够阻断锌介导的β-淀粉样蛋白聚集的化合物,这反过来又将在早期阶段阻止阿尔茨海默病的进展。Vladimir Polshakov说:“利用这个项目中揭示的启动β-淀粉样肽致病聚集的分子机制的信息,我们来自Engelhardt分子生物学研究所的同事已经获得了两种化合物的专利,能够终止β-淀粉样肽的聚集。这些化合物在动物模型上的性质研究证明,它们能够降低几倍的风险疾病进展。”
进一步探索