一种新的蛋白质调节癌症免疫力,可以提供治疗目标
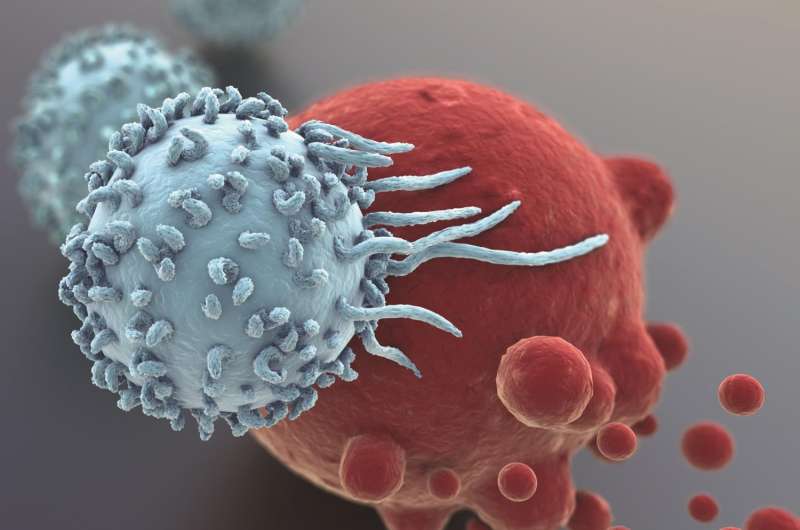
在2017年3月13日之前发布的在线发布的文章临床调查杂志,南卡罗来纳州医科大学调查员报告临床前研究表明,Moesin,膜 - 域组织蛋白,控制调节性T细胞(Treg)功能以及转化生长因子-β(TGF-Beta)的丰富和稳定性细胞表面上的受体,为癌症免疫疗法提供潜在的治疗靶标。
他们的研究结果表明,TGF-β作用于蛋白质水平以产生肿瘤微环境的Tregs。虽然人类免疫系统能够消除癌症,但Tregs抑制免疫应答和保护癌细胞针对肿瘤杀灭(即细胞毒性)T细胞。MOSC研究是首次表明消除Moesin可降低TGF-β受体表达和随后的Treg代来恢复抗肿瘤免疫力。
T细胞,一个亚型白血细胞,可以有效地攻击和杀死肿瘤细胞当由蛋白质TGF-β激活时。然而,免疫系统具有复杂的检查和平衡网络,以确保身体不会产生这么多的这些细胞毒性T细胞,其损害其自己的细胞和组织。当免疫反应完成时,TGF-β发出幼稚T细胞,以使其成为抑制和降解活化的炎性T细胞的Treg,确保它们不会过度产生可导致自身免疫疾病的免疫因子。
癌细胞已经学会了劫持该系统的检查和平衡以隐藏肿瘤杀伤T细胞。许多癌症产生TGF-β,其结合肿瘤杀伤辅助T细胞上的受体,因此不能招募它们以对抗肿瘤。T细胞转化为Tregs,其抑制免疫应答对抗癌症。
抑制moesin可以有助于防止幼稚T细胞转化为Tregs,从而恢复抗肿瘤免疫反应。
“因为Moesin支持更大的Treg生产,我们可以设计Moesin抑制剂来停止或缓慢活跃的TGF-β信号传导,缓慢降低Treg转化,使抗肿瘤T细胞可能有机会看到癌症并消除它,”Zihai Li解释, M.D., Ph.D., chair of the Department of Microbiology and Immunology at MUSC and senior author on the paper.
Philip Howe,Ph.D.,Musc的生物化学和分子生物学系主席和本文共同作者的早期研究证明,许多TGF-β介导的上皮间充质转换基因包括Moesin,被RNA压制- 在健康上皮细胞中粘合蛋白质,通过TGF-β刺激可以恢复Moesin表达。
这种TGF-β震动莫森表达的这种能力导致团队调查Moesin在Treg代中的作用。与MUSC的其他同事共同,该团队比较了辅助T细胞的能力,没有MOESIN成为ITREGS。他们发现Moesin通过与TGF-β受体(TβR-II)相互作用来促进Treg生成,以使其更具可用,从而增强TGF-β信号传导。相反,在没有Moesin的情况下降低了TGF-β发信号,损害了Tregs的发育和功能。
也许通过涉及在黑色素瘤的小鼠模型中的采用T细胞治疗的研究提供了最引人注目的结果。在采用T细胞疗法中,肿瘤杀灭T细胞从具有癌症的人或动物“收获”,并在再灌注进入供体之前扩增或以其他方式“增压”。虽然这些重新使用的细胞在杀死肿瘤时可以非常有效,但它们并不总是在长期生存,设置复发阶段。
这些Musc研究团队表明,这些重新使用的抗癌CD8 + T细胞不仅在缺乏Moesin的小鼠中进行了快速的活化和扩张,而且它们也在更长的时间内存活,降低复发的可能性。实际上,在采用T细胞转移后,具有Moesin的所有小鼠复发,而缺乏Moesin的大多数小鼠被固化。
“当缺乏Moesin的小鼠没有复发时,这真的很令人兴奋。我们不仅删除了Moesin,而且,当我们给了T细胞到活性肿瘤时,那些T细胞可以很长一段时间控制癌症,”Ephraim Ansa解释说-Addo,Ph.D.是微生物学系和免疫学系的博士后研究员,并在文章上提交人。
这些研究结果表明,Moesin可以是制定癌症和Treg相关免疫障碍新治疗的治疗靶标。Moesin的化学调节剂可以控制T的功能细胞通过抑制癌症中的Moesin或诱导其治疗自身免疫疾病。Moesin调节剂也可以与目前的免疫疗法方案结合。
“这些发现对该领域非常有趣,并为进一步研究提供了大量方向,”李说。
进一步探索












用户评论