确定的遗传相互作用为青光眼疗法提供了可能的新目标
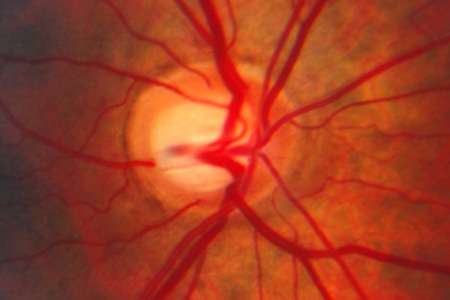
美国加州大学圣地亚哥分校(University of California, San Diego School of Medicine)的科学家们阐明了一种基因相互作用,可能被证明是青光眼(glaucoma)发展和发展的关键。青光眼是一种致盲性神经退行性疾病,影响着全球数千万人,是导致不可逆转失明的主要原因。
在9月10日在线问题发表的调查结果分子细胞,表明一种治疗眼病的新治疗靶标。
主要开放角度青光眼(POAG)是最常见的青光眼,超过300万美国人受其影响,主要是50岁以上的人群。眼内压力(称为眼压)和年龄是POAG的主要风险因素,导致进步退化视网膜神经节细胞,造成视神经损伤及最终视力丧失。
遗传学也起到了作用。最近的基因组协会研究已经确定了两个基因 -SIX1-SIX6和p16INK4a分子-与POAG密切相关。SIX6需要适当的眼睛发育。P16INK4a分子不可逆地阻止细胞生长,这种现象叫做衰老。
在他们的新论文中,首席调查员康章,MD,博士,士气在UC San Diego Health的Shiley Eye Institute的眼科遗传学教授,以及同事报告了一些变体SIX6提高表达的p16INK4a分子,进而加速视网膜神经节细胞的衰老和死亡。
“我们也展示了这一点高眼压在青光眼增加了表达p16INK4a分子,使其成为固有的遗传和环境的关键整合者风险因素会导致青光眼,”张说。
研究结果表明抑制p16INK4a分子可以为青光眼提供新的治疗方法,目前受药物较低的药物治疗。“虽然降低眼内压力会减缓疾病恶化,但它不会阻止它并防止进一步的细胞死亡或可能的失明,”塞维特研究所的眼科教授和兴业研究所主任教授。
作者指出,在小鼠模型上的早期研究已经表明选择性消除p16INK4a分子- 阳性衰老细胞可以预防或延迟与年龄相关的组织劣化。
根据加州大学圣地亚哥分校的研究小组的说法,下一步是进行临床前研究,以评估反义寡核苷酸的有效性和安全性。反义寡核苷酸是合成的DNA或RNA链,可以防止遗传信息的转移p16INK4a分子表达及预防青光眼恶化。“如果它们有效,我们可能会考虑在未来进行人体临床试验,”张说。
进一步探索











用户评论