“缠结”触发了新皮层网络中的早期阿尔茨海默氏症异常
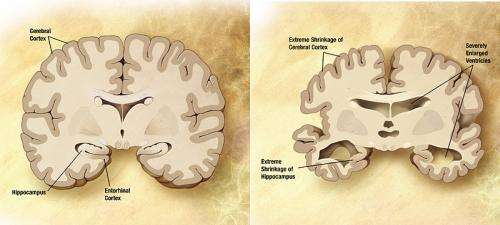
阿尔茨海默氏病(AD)是一种神经退行性疾病,它是使我们人性化的核心:思考,感受,记住和与周围的人交流的能力。这场悲剧是由于目前没有治疗方法,没有治疗方法和诊断方法能够在早期阶段识别阿尔茨海默氏病的事实。
现在,一项开创性的研究在任何地方都首次表征了个人内部发生的早期变化,即完整大脑中受阿尔茨海默氏症受影响的细胞。值得注意的是,研究表明,即使仅影响少数细胞,结果也是减少电活动在整个大脑皮层中 - 大脑区域是较高的心理功能和认知的中心。
研究人员 - 博士。Bar-Ilan大学的Edward Stern和Dana Cohen以及爱丁堡大学的Tara Spire-Jones博士 - 在学术期刊上发表了他们的发现神经元2015年2月19日。
一个纠结的网络
该研究的主要作者爱德华·斯特恩(Edward Stern)博士是巴尔 - 伊兰大学(Bar-Ilan University)的贡达(Goldschmied)多学科脑研究中心的成员,并且还在美国马萨诸塞州马萨诸塞州马萨诸塞州马萨诸塞州的Masseneral神经退行性疾病研究所任命。他解释说,这项研究的戏剧性结果部分是由于科学家决定着重于很少研究的脑细胞病理学,称为“缠结”。
斯特恩说:“阿尔茨海默氏病与三种病理有关:细胞死亡,淀粉样斑块的细胞外堆积和缠结 - 细胞丝的异常扭曲,使神经元保持正常形状。”通过一种称为tau的蛋白质的异常形式。
“虽然已经知道病理tau与痴呆有关,但我们的研究是揭示神经变性基础的细胞和网络活性变化的第一项研究。重要的是,我们发现,即使少数细胞也是如此有缠结,这会在整个网络中造成毁灭性的效果,其特征在于,神经元间通信之间的长期潜伏期以及突触活动的整体水平的降低。”
在完整的大脑中记录基于网络的“对话”
通过使用一种使它们能够在完整的转基因小鼠的麻醉大脑中定位电极在单个细胞内定位电极的技术,从而使研究人员的观察结果成为可能。研究这些小鼠 - 基因改变以产生缠结的触发异常TAU蛋白 - 科学家测量了电活动的自发性亚阈值波动。他们还观察到神经元活性模式如何响应刺激。
Noa Menkes-Caspi博士进行的实验,当时Stern的实验室中的博士候选人表明,病理学tau破坏了单个细胞的活性以及新皮层中的细胞内通信。在任何显着的细胞死亡之前观察到这种现象,而只有一小部分神经元显示出完全发达的缠结的时候。
根据斯特恩的说法,这些结果表明,阿尔茨海默氏症的症状 - 长期以来怀疑是由淀粉样蛋白β的细胞外积聚引起的,也是由tau异常积累引起的单个细胞。通过降低单个神经元的速度,缠结采取行动抑制突触活动在更广泛的新皮质网络中,导致认知功能降低。斯特恩(Stern)表明,两种病理学结合了毁灭性的作用,以改变大脑的神经元活动模式,从而导致阿尔茨海默氏病症状。
具有医疗潜力的及时信息
斯特恩指出,这项研究代表了神经生理学异常首次与网络水平上的脑行为变化有因果关系。他指出,这些数据最终可能会指向一个难以捉摸的临床医学目标:一种积极识别阿尔茨海默氏症的方法,在为时已晚之前。
他说:“既然我们已经表征了新皮层电活动的模式,那么在存在缠结的细胞和淀粉样蛋白β受影响的大脑的情况下,有可能用脑电图筛选这些模式。”通常用于鉴定癫痫和其他脑部疾病的技术。“这有一天可能构成早期诊断的基础。”
斯特恩还认为这些发现是朝着有效阿尔茨海默氏症治疗的长期目标迈出的重要一步。
他说:“关键是将病理学与正常神经元进行比较,并确定可能逆转异常神经活动的方法。”“由于脑细胞活性的变化是导致疾病症状的原因,因此对异常神经生理的更清晰的了解可能会使我们更接近我们所有人想要的东西,以及世界所需要的东西 - 对阿尔茨海默氏病的治疗。”