新型培养系统复制阿尔茨海默病的病程,证实了淀粉样蛋白假说
一种创新的实验室培养系统首次成功地再现了阿尔茨海默病发展的全过程。麻省总医院(Massachusetts General Hospital, MGH)基因与衰老研究中心的研究人员使用他们开发的系统,现在提供了第一个明确的证据,支持大脑中-淀粉样斑块的沉积是导致毁灭性神经退行性疾病的级联反应的第一步这一假设。他们还确定了酶在这一过程中所起的重要作用,抑制酶可以作为治疗靶点。
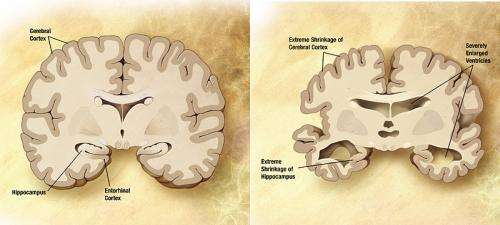
最初提出于20世纪80年代中期淀粉样蛋白假说认为大脑中的-淀粉样蛋白沉积引发了所有后续事件——神经纤维缠结阻塞了神经元内部,神经元细胞死亡Rudolph Tanzi博士说,他是MGH基因和衰老研究单位的主任,也是该报告的高级合著者,该报告已在网上提前发表自然。“从那时起,最大的问题之一就是-淀粉样蛋白是否真的引发了杀死神经元的缠结的形成。在这个我们称之为“皿中老年痴呆症”的新系统中,我们首次证明了这一点淀粉样蛋白沉积足以导致缠结和随后的细胞死亡"
而阿尔茨海默病的小鼠模型,表达的基因变异导致遗传的早发形式的疾病确实发展淀粉样斑块在他们的大脑和记忆缺陷中,引起大部分损伤的神经原纤维缠结没有出现。其他模型成功地产生了缠结,但没有产生斑块。培养的阿尔茨海默氏症患者的神经元显示出斑块中淀粉样蛋白的毒性水平升高,以及构成缠结的tau蛋白的异常版本,但不是真正的斑块和缠结。
遗传学和老龄化研究单位的研究员Doo Yeon Kim博士,共同高级作者自然意识到通常用于培养细胞的液体二维系统不能很好地代表大脑内胶状的三维环境。相反,MGH团队使用了一种以凝胶为基础的三维培养系统来培养人类神经干细胞,这种干细胞携带着两个基因的变异淀粉样前体蛋白早发性家族性阿尔茨海默病(FAD)的基础已知的早发性家族性阿尔茨海默病。这两种基因都是在Tanzi的实验室中共同发现的。
在生长六周后,人们发现fad变异细胞在典型形式的-淀粉样蛋白和与阿尔茨海默氏症相关的有毒形式中都有显著增加。变异细胞还包含神经原纤维缠结窒息神经细胞内部,导致细胞死亡。阻断淀粉样斑块形成的关键步骤也阻止了缠结的形成,证实了淀粉样蛋白在启动这一过程中的作用。缠结中发现的tau蛋白的特征是存在过量的磷酸盐分子,当团队研究阻断tau蛋白产生的可能方式时,他们发现,抑制一种名为gsk3 - β的酶的作用——已知的能磷酸化人类神经元中的tau蛋白——可以阻止tau蛋白聚集和缠结的形成,即使存在大量的-淀粉样蛋白和淀粉样斑块
Tanzi说:“这个新系统——可以适应其他神经退行性疾病——应该在速度、成本和与疾病的生理相关性方面革新药物的发现。”“在通常有斑块或缠结的大脑沉积物的小鼠模型上测试药物,需要一年以上的时间,而且非常昂贵。我们的三维模型概括了斑块和缠结在美国,我们现在可以在几个月的时间里筛查数十万种药物,而不用在一个与阿尔茨海默氏症患者大脑中发生的事件相关得多的系统中使用动物。”
进一步探索










用户评论