研究人员揭示了在严重感染期间保护肺部的细胞机制

伊利诺伊大学的研究人员在芝加哥发现了一种新型的分子机制,可以收紧线血管之间的细胞之间的粘合,形成防漏屏障。该机制提出了治疗急性呼吸窘迫综合征(ARDS)的潜在新靶标,通常致命条件,其中液体从血管中泄漏到肺部中。
由Schweppe家族杰出教授、药理学主任Asrar Malik领导的UIC研究人员发现,他们可以使用一种名为Fg4497的小分子在小鼠体内触发细胞收紧机制。与未使用该化合物的小鼠相比,暴露于导致液体进入肺部的感染源的小鼠存活率更高,液体积累也更少。
调查结果报告临床调查杂志。
ARDS在大约一半的案件中是致命的。目前的标准治疗是支持性护理,如人造通气。很少有疗法能够成功地逆转流体泄漏。
UIC医学院药理学和医学副教授、该研究的主要作者之一Jalees Rehman博士说:“在急性呼吸窘迫综合征中,我们身体自身的免疫反应成为一个主要问题。”
作为身体正常,健康的免疫应答感染的一部分,屏障由血管细胞暂时放松,允许白细胞拉赫曼说,它们可以离开血液,攻击入侵的细菌或病毒。
然而,他说,在某些严重的肺炎或血液感染病例中,这一屏障并没有得到适当的修复。持续性肺漏尤其成问题。急性呼吸窘迫综合征(ARDS)患者通常使用人工呼吸机并给予补充氧气。
“这是一种炎症的恶性循环和肺血管泄漏,非常难以控制,”雷曼说。“就好像肺部淹没在身体自己的流体中。能够通过稳定和恢复血管屏障的完整性来防止这种情况可以帮助拯救生命。”
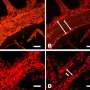
Rehman和他的同事研究了一种叫做粘附连接的调节细胞间接触的机制。他们知道一种叫做VE-PTP的分子在稳定粘附连接方面很重要。
在具有人肺血管细胞的实验室实验中,研究人员发现低氧条件诱导氧敏感基因调节器HIF2α的表达,这反过来增加了Ve-PTP水平。
缺乏hif2 α的小鼠与能够产生hif2 α的小鼠相比,VE-PTP的水平要低得多,而且有更大的血管渗漏。
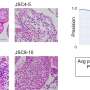
他们发现,如果暴露于血流感染的小鼠被赋予一种模仿低氧的效果,HIF2Alpha和Ve-PTP升级的药物和血管变得较小的药物。这些小鼠在未给药的小鼠中显着更高的存活率和肺的流体较少。
“它有道理的是,低氧会诱导这种级联的分子事件,导致屏障紧缩,”雷曼说。“似乎血管细胞在低氧气应力情况下有自己的方式收紧屏障。”由于肺开始填充液体,血液变氧化,细胞衬里血管通过收紧粘附连接反应。然而,在急性呼吸窘迫综合征(ARDS)患者中,这种应对低氧而增强屏障的自然能力可能不会很快发生。
“我们目前的研究进行了老鼠,但我们希望有一天,我们将能够利用身体对低血氧水平的含有模仿低氧气条件的药物的自然反应。雷赫曼说,这些药物可以给予高危患者,并希望通过激活内部保护屏障紧固机制来防止形成ARDS。“
进一步探索









用户评论