als背后的分子生物学
UA研究人员已经确定了运动神经元的分子缺陷,其可能有助于解释ALS的机制,或Lou Gehrig病的疾病。
到目前为止,大多数人都看到了各种各样的朋友和家人在冰冷的水中的社交媒体中看到了视频,作为ALS冰桶挑战的一部分。
2014年的竞选是提高意识的努力的一部分肌营养的外侧硬化或Als,一种毁灭性的神经变性疾病,导致渐进的肌肉削弱和协调丧失。但是,媒体中的飞溅速度较少是研究人员正在做的事情来解决这个问题。
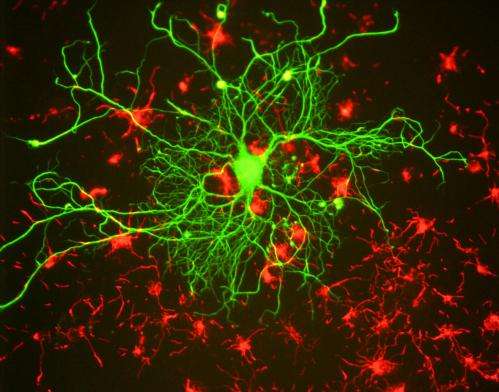
als难以理解,且相对较少的是究竟如何以及为什么发生这种情况。在罕见的发现中,神经元和肌肉之间的连接点发现了明显的分子缺陷,这可能会对ALS的基本机制提供更大的洞察力,根据Daniela Zarnescu,亚利桑那大学副教授的一项新研究分子和细胞生物学,以及UA神经科学研究生跨学科计划的研究生和Alyssa Coyne。本文发表于此神经科学杂志。
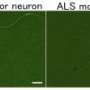
在健康的人身上,称为电动机神经元的神经细胞在称为神经肌肉连接点的地方与肌纤维接触,这允许适当地控制运动和其他关键功能。在ALS患者中,电机神经元在开发管中消失,防止这些连接发生。
为了学习Als,Zarnescu和Coyne使用果蝇果蝇Melanogaster作为他们的模型,这为研究人员提供了分子和遗传方法的优势,使他们能够更容易地查明完全何时何地出现问题。
“当你告诉人们你使用水果作为人类疾病的模型时,你会得到一些有趣的外表,”Zarnescu说。“但使用简单的模型可以帮助您在疾病的背景下揭示真正重要的。”
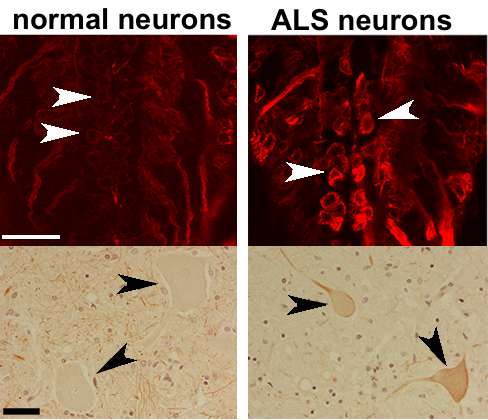
扎内斯库和科因研究了一种名为TDP-43的蛋白质,这种蛋白质此前与肌萎缩性侧索硬化症有关。研究小组发现,TDP-43调节另一种名为Futsch的蛋白质在神经肌肉接点的生成和运输。在肌萎缩侧索硬化模型中,TDP-43阻止Futsch到达神经肌肉接点,从而导致连接错误。
“Alyssa发现这种特殊的分子没有适当调节。它不是在正确的地方或以合适的金额制作的,”Zarnescu说。“而不是被运送到神经肌肉接头,它留在电池的主体上,无法保持连接的稳定性。“
然后,研究人员想确定是否增加了FUTSCH蛋白的量,有助于修复差的连接。令人惊讶的是,过度表达过度的Futsch在运动神经元中产生了增加连接稳定性的效果,增加了寿命运动神经元并在ALS果蝇中恢复电机功能。
在这一点上,你可能会问:苍蝇的神经系统中的als与人类的als有什么关系?
为了找到答案,扎内斯库和科因与凤凰城巴罗神经学研究所的研究人员合作,观察了肌萎缩性侧索硬化症患者的脊髓细胞。该团队研究了一种名为MAP1B的蛋白质,它是Futsch蛋白质的哺乳动物版本。值得注意的是,MAP1B定位的改变与果蝇中的Futsch蛋白非常相似。这种相似性表明,人类和苍蝇的肌萎缩性侧索硬化症模型都存在类似的缺陷。
“这突显了在简单模型中研究人类疾病的重要性,”Zarnescu说。“这些模型非常强大,并且预测人类患者中发生的缺陷。”
根据Zarnescu和Coyne的说法,调查结果代表了理解和最终治疗疾病的重大步骤。
“这项研究是第一个突出在ALS中突触连接处如此明显的分子缺陷之一,”Zarnescu说。“我们还不知道ALS中发生了什么,但此发现提供了可能的解释。”
进一步探索








用户评论