使用“诱导多能性”细胞技术建模先天性amegakaryocytic血小板减少
研究员领导的研究小组真嗣Hirata CiRA Koji埃托奥教授进行了一项研究,“诱导多能性”细胞来自患者先天性amegakaryocytic血小板减少症(CAMT)体外诱导分化成血细胞,然后使用进行详细的研究这些来自健康受试者和细胞之间的区别。研究人员发现,在人类中,促血小板生成素受体不仅维护至关重要的多功能造血祖人口和血小板的生产,而且红细胞生成(红细胞生产)。
CAMT是由先天性促血小板生成素受体介导细胞内信号的损失,导致严重的状态血小板减少症从出生,导致婴儿时期骨髓衰竭和逐渐枯竭的红色血细胞然后的白细胞。这种严重的疾病需要骨髓移植对患者生存,但缺乏一个足够了实验模型迄今为止一直是阻碍阐明其病理。在目前的研究中,与一个CAMT病人的合作已经收到了骨髓移植和恢复,iPS细胞(CAMT iPS细胞)生成和体外诱导分化成血细胞,详细分析了其行为。
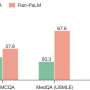
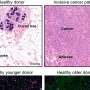
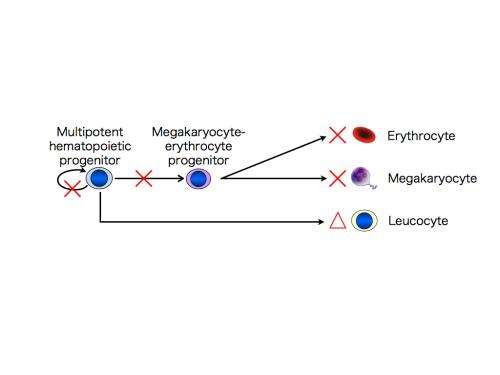
CAMT iPS细胞,如CAMT病人最初的血液细胞,促血小板生成素受体没有功能。检查能力分化成巨核细胞,血小板,红细胞(红细胞),和其他类型的细胞,这些“诱导多能性”细胞分化成多功能造血祖细胞,可反过来血细胞分化成各种不同的类型。发现的多功能造血祖细胞来源于CAMT iPS细胞,与健康受试者的iPS细胞,不仅有能力受损发展成巨核细胞和血小板,而且进入红细胞。然而他们保留一些分化成的能力白细胞。这些特征密切反映病理状态中看到CAMT病人(图1)。
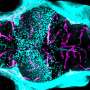
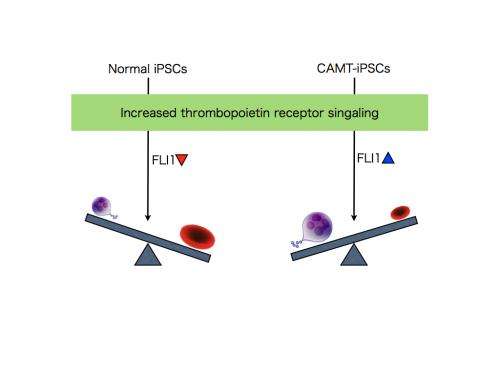
接下来,CAMT iPS细胞受到补偿促血小板生成素的转导受体通过基因工程,规范化的生产三个巨核细胞,血小板和红细胞。改变量的促血小板生成素受体引入把它在健康受试者的水平产生了分化模式类似于健康受试者,红细胞比巨核细胞的倾向。有趣的是,超表达促进分化成巨核细胞在分化成红细胞CAMT patient-derived科目。探讨fate-determining机制决定之间的分化成巨核细胞和红细胞,研究人员检查了转录因子促血小板生成素受体下游信号进行操作。这次考试表明,当促血小板生成素受体信号过程中进一步加强分化成巨核细胞和红细胞,在健康受试者FLI1减少,但相比之下高架在CAMT iPS细胞(图2)。
通过使用“诱导多能性”细胞产生CAMT患者,研究小组成功地繁殖CAMT的病理状态,生产巨核细胞和红细胞白细胞生产相比明显减少。此外,团队建立,在人类,促血小板生成素受体信号传导起着重要的作用在维护多功能造血祖细胞的分化成megakaryocyte-erythrocyte祖细胞,因此红细胞生成的关键。这个发现可能没有鼠标模型在世界范围内通用。这样,利用iPS细胞技术使得它不仅可以分析疾病,而且调查造血作用的机理。这个研究的发现表明,thrombopoietin-like药物目前用于促进血小板治疗贫血也可能是有用的。展望未来,“诱导多能性”细胞模型这种疾病将作为一个重要的工具在研究人类造血作用的起源和造血作用途径。