新的模型促进了对致命的人类朊病毒疾病的研究
通过直接操纵朊病毒蛋白编码基因的一部分,怀特黑德研究所的研究人员创建了两种对人类致命的神经退行性疾病的小鼠模型。用这些模型所看到的疾病病理学的高度准确再现应该会促进对这些不寻常但致命疾病的研究。
通过改变基因中的单个氨基酸密码子基因编码对于朊病毒蛋白,在基因组的自然环境下——没有过度表达或其他人工操作——我们可以产生完全不同的蛋白神经退行性疾病,每一个都会自发地产生一种传染性朊病毒,”怀特黑德成员苏珊·林德奎斯特说。“这项工作无可辩驳地建立了朊病毒假说。”
根据朊病毒假说,朊病毒蛋白通过模板方式传递其错误折叠的形状来进行感染,这与依赖DNA或RNA来传递信息的病毒或细菌不同。对朊蛋白(PrP)创造了一个畸形的结构,这是复制的接触。错误折叠的蛋白质积累,形成对周围组织有毒的团块。
PrP在大脑中表达量很高,而且朊病毒疾病,包括人类的克雅氏病(CJD)、牛海绵状脑病(BSE)或“疯牛病),绵羊的痒病会对大脑和其他神经组织造成严重破坏。一些朊病毒疾病,如疯牛病,可以从饲料动物传染给人类。
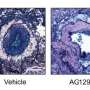
迄今为止,由于缺乏忠实地模拟人类疾病过程的动物模型,对这些极不寻常但具有毁灭性的朊病毒疾病的研究一直受到阻碍。然而,林德奎斯特实验室的前博士后研究员沃克·杰克逊正在改变这一现状,他创造了人类致命家族性失眠症(FFI)和CJD的新型小鼠模型。他的研究发表在本周的美国国家科学院院刊(PNAS).
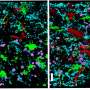
为了生成模型,Jackson通过改变一个密码子——基因中编码蛋白质中各种氨基酸的三个核苷酸“词”之一——创造了两个突变的prp编码基因。已知一种突变可引起FFI,而另一种突变可诱发CJD。与之前随机将突变插入基因组,偶尔增加PrP表达的模型不同,杰克逊的模型忠实地模拟了人类疾病——从疾病的发病,到PrP的产生,再到传染性。在大脑中,他的FFI小鼠在丘脑中出现神经元损失,而他的CJD小鼠在海马体和小脑中出现海绵变性,反映了人类患者大脑中的损伤。
“沃克(杰克逊)的工作提供了两种不同寻常的神经退行性变模型,”林德奎斯特说,他也是麻省理工学院的生物学教授。“大多数小鼠模型产生的病理仅与人类疾病略有相似。这是世界上最神秘的两种人类疾病。”
有了FFI和CJD模型,Jackson说他很兴奋能研究这些疾病的病理发展。
“现在我们有两个有趣的模型,选择性地针对大脑的特定部分:FFI的丘脑和CJD的海马体,”杰克逊说,他现在是德国神经退行性疾病中心的小组负责人。“但我们不会关注受这种疾病严重影响的地区,而是会关注那些似乎在抵抗这种疾病的地区,看看它们在做什么。蛋白质是存在的,但出于某种原因,它没有毒性。”
进一步探索
对其中一个模型(FFI)的初步描述是早些时候报道的神经元.





用户评论