基因替代治疗小鼠铜缺乏症
(欧宝娱乐地址医学Xpress) - 基因治疗加上铜的注射大大提高了小鼠的存活,其案件根据研究人员在国家卫生研究院的研究中,致致命的儿童疾病疾病。
门克斯氏病是由ATP7A基因功能不全导致的。通常,这种基因会帮助人体处理微量金属铜。在门克斯病中,基因失灵。因此,铜不能用于适当的开发。虽然这种疾病会影响到整个身体,但最明显的是大脑,与其他器官和组织相比,大脑在发育过程中需要相对较多的铜。铜被用于金属的形成红细胞,并保存神经系统组织,骨骼和免疫系统健康。
五万分之一到十万分之一患有这种综合症新生儿据该研究的资深作者、医学博士斯蒂芬·卡勒(Stephen Kaler)称,他们中的绝大多数都是男孩。他是美国国立卫生研究院(NIH)尤妮斯·肯尼迪·施莱弗国家儿童健康与人类发展研究所(NICHD)的分子医学项目人体铜代谢单元的负责人。这种疾病的严重程度不同,取决于基因被禁用的程度。那些基因功能最糟糕的人情况最糟,通常很早就去世了。卡勒博士解释说,目前的治疗方法是每天注射铜,直到孩子3岁。
当早期检测到Menkes疾病时,铜注射可以有效,并且存在一些能够处理铜的能力,如在具有部分功能的ATP7A基因的情况下。然而,严重和先进的病例一般不可治疗。大多数有疾病的孩子在达到3岁之前死亡。
在他们的研究中,卡勒博士和他的同事们测试了一种添加正常ATP7A副本的治疗方法老鼠基因复制出故障。他们的结果表明,有一天可能为门克斯病患者提供一种功能正常的ATP7A基因。
“即使我们迄今为止的最佳努力,这种疾病的死亡率仍然很高,”Kaler博士说。“这些疾病小鼠模型中的这些前临床发现表明基因治疗可能是一种帮助那些患有Menkes疾病的人婴儿,谁目前最难以治疗。“
这项研究的第一作者是安东尼·唐桑特博士,他也是来自人类铜代谢单位。其他作者包括美国国立卫生研究院(NIH)国家神经疾病和中风研究所(National Institute of Neurological Disorders and Stroke)、明尼苏达大学德卢斯医学院(University of Minnesota Medical School in Duluth)和武装部队病理学研究所(Armed Forces Institute of Pathology)的研究人员。
研究结果在杂志上出现在线分子治疗。
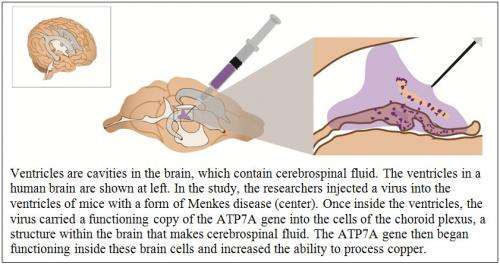
研究人员使用一组ATP7A基因基本失效的小鼠进行研究。在这些小鼠中,运输铜的能力被严重破坏。这些动物仅对铜注射没有反应,通常在出生后两周内死亡。功能性ATP7A基因通过携带基因的无害病毒插入动物的大脑中。一旦注射,病毒的副本进入了动物的大脑中的一些细胞。然后ATP7A基因开始在这些脑细胞内部发挥作用,并增加加工铜的能力。
研究人员将老鼠分成三组。他们将铜单独注射到第一组老鼠体内。他们将含有atp7a的病毒单独注射到另一组小鼠体内。这两组小鼠的寿命往往比未接受治疗的小鼠长两到三天。然而,没有一只存活超过三周的老鼠,而三周是老鼠脱离母体的典型年龄。
在第三组小鼠中,研究人员首先注射了含有atp7a的病毒,然后,一天后,注射了一剂铜。平均而言,这些小鼠的存活时间是未治疗小鼠的三倍。近90%的婴儿存活到断奶。出生10个月后,超过20%的人仍然存活。
经过进一步的研究,研究人员发现,接受ATP7A +铜治疗的小鼠大脑中的铜含量要比原来高得多铜未经治疗的小鼠的大脑中的水平。此外,经过处理的小鼠的大脑显示比未处理的小鼠的大脑更小。
卡勒博士解释说,这项研究的成功可能是因为大脑中注射了携带atp7a病毒的区域。研究人员将这种治疗方法注射到脑室里,脑室里充满了液体。这种液体被称为脑脊液,因为它浸泡大脑和脊髓。脑脊液是由脑室内的特殊细胞——脉络丛上皮细胞制造的。当研究人员检查大脑时组织从小鼠中,他们发现注射的ATP7A基因已掺入这些细胞中。
“整个生命中,脉络丛细胞被非常不经常更换,这表明这种治疗的有益效果可能无限期地持续存在,”Kaler博士解释说。
将组合治疗直接注射到脑室内的脑室中有效地在小鼠中是有效的。但直接注射到大脑有肿胀和感染的风险。对于门克斯氏症患者来说,最好是找到其他侵入性较低的方法来传递替代基因。一种可能的方法是使用一种称为腰椎穿刺的常见注射程序,将治疗方法注入下背部脊髓腔的脑脊液中。
进一步探索











用户评论