表观遗传途径和新药物中扭转了童年不易治愈的癌症
儿童期白血病的难治性形式依赖于DNA结构的变化——所谓的表观遗传变化造成白细胞基因组内破坏,根据两种研究由波士顿儿童医院的研究小组和丹娜-法伯癌症研究所。从生物技术公司与合作者一起,相同的团队还表明,一个新的药物,阻止这些变化可以禁用促进基因和停止这种癌症的发展。
这些研究发表在一对文件在7月11日,2011年癌症细胞,是第一个治疗目标核心小组的表观遗传脆弱性白血病引起的混合血统的“重组”或重排白血病MLL基因。
“我们已经知道了一段时间,MLL白血病来自广泛的改变不是代码本身的遗传,但在DNA和蛋白质的结构与它有关,”斯科特·阿姆斯特朗,医学博士,博士,在儿童和dana - farber儿科肿瘤学家。“我们现在确实表明,这些表观遗传变化打开促进基因内白细胞,并最终导致白血病。
“更重要的是,”他继续说道,“我们表明我们可以扭转的过程。”
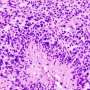
而儿童白血病癌症治疗中最伟大的成功故事之一,这些由MLL基因重组是毁灭性的例外。在这些癌症,11号染色体的一部分(MLL基因所在)脱落和其他染色体融合与地区创造新的融合蛋白。融合蛋白的破坏MLL基因的正常功能,激活一组leukemia-causing基因。
MLL基因重组占大约10%的儿童和成人患有急性淋巴细胞白血病或急性骨髓性白血病;大多数病人不标准的白血病治疗反应良好。
“其他儿童白血病治疗的成功率已达到90%或80,”阿姆斯特朗说。“然而,我们还只在治疗MLL-rearranged白血病获得约50%的成功。我们需要找到更好的方式照顾这些病人,和这些结果给了我们信心,我们正朝着正确的方向前进。”
阿姆斯特朗曾表明MLL-rearranged白血病细胞有一个独特的组蛋白甲基化的模式,一种特殊的表观遗传修饰,由一种叫做Dot1l的酶引起的。这种酶,招募MLL-fusion蛋白质,促进基因的高度上的特定氨基酸甲基组蛋白(一种支架蛋白,帮助管理基因激活)称为组蛋白H3。
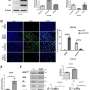
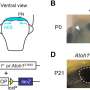
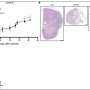
在第一个癌症细胞论文,阿姆斯特朗和凯瑟琳Bernt,医学博士和安德鲁,医学博士,博士,儿童和dana - farber证实基因称为MLL-AF9 MLL融合蛋白的目标与甲基化组蛋白H3不当相关蛋白质。通过基因灭活Dot1l,团队可以消除MLL-specific组蛋白甲基化和基因表达模式在细胞疾病的小鼠模型。此外,他们发现小鼠注射白血病细胞缺乏Dot1l没有出现白血病,相比那些注射Dot1l白血病细胞具有活跃。
“我们以前的工作表明Dot1l是异常甲基化模式背后的罪魁祸首MLL-rearranged细胞,”阿姆斯特朗说。“我们现在知道,这些白血病完全依赖这种酶和甲基化模式生成为了坚持和成长。
“虽然在组蛋白甲基化标记很难直接操纵,”他补充道,“Dot1l更容易治疗目标。”
第二个癌症细胞纸,由阿姆斯壮,Bernt Epizyme宫和合作者的生物技术公司,需要Dot1l发现了一步,显示一个名为EPZ004777的小分子,抑制了酶,确实在MLL细胞消除异常甲基化模式。细胞在实验室模型,治疗的效果与EPZ004777反映那些通过灭活Dot1l转基因老鼠“击倒”,而选择性地使MLL-rearranged白血病细胞死亡在大约两周的时间。此外,小鼠MLL-rearranged白血病显示增加生存EPZ004777处理时。
“肿瘤学领域非常兴奋现在后生抑制,”阿姆斯特朗说。“酶像Dot1l影响表观遗传学是活跃在许多癌症。我们所做的就是显示我们可以阻止这些酶之一,非常具体的抗肿瘤活性在以前非常难以治愈的疾病。”