研究人员澄清蛋白质在多发性硬化症中的作用
斯坦福大学医学院(Stanford University School of Medicine)的研究人员报告称,一种主要存在于眼睛晶状体中的蛋白质可能是多发性硬化症中炎症和损伤螺旋上升的关键“临界点”。
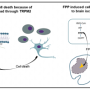
这种蛋白质——α -晶体蛋白——通常不存在于大脑中,而是在多发性硬化症对神经细胞造成损伤时产生的。神经细胞损伤会导致人们失去运动控制,甚至瘫痪。
“这篇论文的重大突破是回答了‘字母-晶体蛋白在做什么?医学博士、神经学和神经科学教授劳伦斯·斯坦曼(Lawrence Steinman)说。斯坦曼和他的团队证明了这种蛋白质在多发性硬化症小鼠模型中起着保护作用——当注射到小鼠体内时,它可以逆转瘫痪。他们的研究结果将发表在6月13日的网络版上自然。
在多发性硬化症中,免疫系统发动攻击肌蛋白鞘周围神经细胞,导致它们失火。根据多发性硬化基础,美国最多可诊断到500,000人的病症,这取决于髓鞘瘢痕的位置和程度,导致不同的症状。常见的症状包括疲劳,虚弱,眩晕,麻木和视觉问题。
由于目前尚不清楚的原因,免疫系统认为在大脑中α -晶体蛋白的表达是一种危险的信号,并攻击这种治愈物质。斯坦曼说:“就像一辆失控的卡车从山上冲下,然后刹车脱落一样,对α -晶体蛋白的免疫攻击会使情况恶化。”他指出,值得注意的是,添加这种蛋白质就像恢复失灵的刹车,恢复控制。
如果在人类中看到相同的恢复,则蛋白质可能会用于治疗多发性硬化症。“这是一个真正的喜悦,看看具有这些保护效果的自然产生的相同材料可能是可能被利用并用作治疗本身的,”斯坦曼说。
该团队对被用作疗法的蛋白质持乐观态度,但Steinman和Shalina Ousman,博士学位,他的实验室中的博士后研究员和出版物的第一个作者强调,从人类测试仍然很长的路要走。
承认这种蛋白质在多发性硬化症中的作用开始十多年前,当荷兰研究员约翰内斯·范·Noort博士发现的主要刺激免疫系统的攻击大脑不可能的罪魁祸首之一,部分髓鞘,但alphaB-crystallin,眼睛的镜头的主要结构蛋白。
“由于某种原因,蛋白质导致大脑上没有预期的大脑,”Steinman说,他在1995年在自然界发表时写了一篇关于Van Noort的发现。从那以后,斯坦曼和田野中的其他人想知道它意味着通常在眼睛的镜片中发现的蛋白质突然出现在大脑中。2001年,Steinman在科学上发表了在多发性硬化症中最丰富的蛋白质编目的工作,发现α结晶素首先排名。
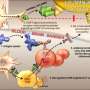
这一发现导致了他和他的同事们对多发性硬化症 - 实验性自身免疫脑炎的小鼠模型进行一系列实验。它们以各种方式显示出小鼠中的α结晶素如何降低炎症并减少与多发性硬化相关的其他病理条件,例如细胞死亡。此外,它们证明了蛋白质的去除增加了小鼠中的神经症状。
“我们必须记住,维修机制通常以造成伤害和压力,”奥斯曼说。“然而,在某些情况下,那些修复机制未能克服有害的反应。重要的是要问为什么这些机制失败,可能会恢复他们的保护功能。”
当他们给患有多发性硬化症的老鼠注射这种蛋白质时,它们的瘫痪情况得到了逆转。乌斯曼解释说,这种蛋白质通过抑制引起损伤的细胞过程来恢复秩序。斯坦曼推测其机制是耐受性——类似于过敏注射的过程,当一个有过敏反应的人注射了导致身体问题的蛋白质,这样身体就可以学会忽略它。
一旦研究人员掌握了小鼠中发生的事情,他们就转向了人类。斯坦曼的团队在哈佛大学医学院的合作者中使用了一系列脊髓液样本,在其抗体阵列上进行了测试。The arrays - developed with Stanford colleagues William Robinson, MD, PhD, assistant professor of medicine, and P.J. Utz, MD, associate professor of medicine - are glass slides spotted with minute amounts of hundreds of myelin sheath proteins to provide a profile of the antibodies' targets.
他们发现,在人类中,最高的抗体反应是针对α-结晶的抗体,导致研究人员推测蛋白质可能会在小鼠中逆转人类的损伤。“我将努力努力从我们的长凳上带到床边,”斯坦曼说,“斯坦曼说,通过与现有公司的合作,或者我们将开始一个新的。”
来源:斯坦福大学













用户评论