研究发现新的分子机制推动药物抗性,在胃癌肿瘤复发
由马斯蒂芬妮Kwai-yee教授领导的一个研究小组从学校生物医学科学,路医学院,香港大学(HKUMed)发现了一个异常的信号通路,RNA编辑控制脂类代谢促进抵抗化疗在胃癌具备干细胞和癌症。研究结果已发表在自然通讯。
胃癌(GC)仍然是癌症相关死亡的主要原因之一,在全球范围内和在香港。战斗GC, 5 -氟尿嘧啶(研究者用)和以铂为基础的联合化疗通常是管理除了手术切除,希望增加手术的有效性或癌症复发的几率降到最低。然而,获得化学抗性的出现最终限制长期临床医学方面的好处。
无数机制推动药物抗性,加上GC构成各种亚型的识别目标覆盖药物抗性。因此,了解subtype-specific漏洞覆盖抵抗化疗是设计改进治疗方案的基础致命的疾病。
研究方法和结果
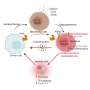
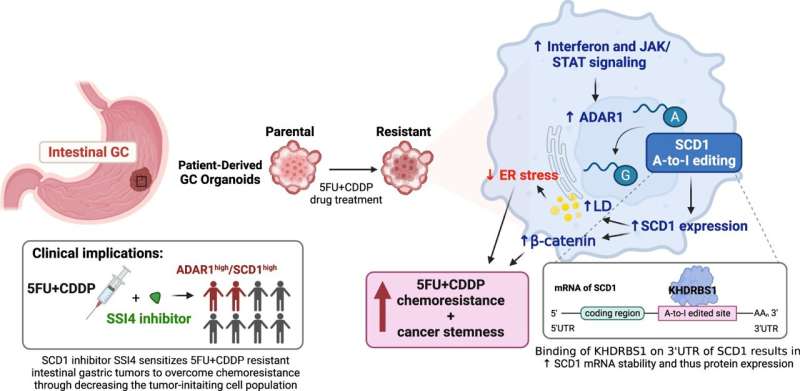
推动药物抗性的研究小组发现了一个未报告的机制,提供编辑在教唆RNA水平差脂质代谢赋予化学抗性具备干细胞和癌症。
通过整合临床肠胃癌patient-derived瀑样线训练模拟研究者用+顺铂耐药性,multi-omic在临床前GC小鼠模型,分析和验证了具有化疗耐药性的所有研究小组发现瀑样显示更大的干扰素和JAK / STAT信号,调节ADAR1表达式。ADAR1,决定了编辑的RNA酶,促进脂质特异表达网络通过编辑多种酶参与脂类代谢,包括一种关键酶,SCD1。
SCD1 RNA的编辑增强mRNA的稳定性,从而增加SCD1蛋白表达。因此,SCD1促进脂滴的形成和丰富β-catenin赋予抵抗癌症化疗以及更具备干细胞状态。应用研究结果为临床使用,团队进一步表明补充SCD1抑制剂(SSI4)在胃癌化疗方案可能逆转药物抗性,减少肿瘤起源子集。
“我们的研究结果发现特异表达编辑在脂质代谢基因的RNA水平作为一种新颖的分子机制电阻在胃癌化疗。通过针对SCD1编辑,我们可以逆转药物抗性癌症具备干细胞。本研究为未来的发展奠定了基础的新治疗这种致命的疾病,”斯蒂芬妮·马教授说Kwai-yee学院的生物医学科学,HKUMed,世卫组织发起了这项研究。
“此外,ADAR1表达和SCD1也可能是良好的生物标记物预测化疗反应胃癌病人。这个备件的病人经历不必要的化疗并允许他们进行更有效的治疗,”Kwai-yee说。
更多信息:黄Tin-Lok et al, ADAR1-mediated RNA编辑SCD1驱动器的耐药性和自我更新在胃癌,自然通讯(2023)。DOI: 10.1038 / s41467 - 023 - 38581 - 8