重点损坏的蛋白质:形状如何引起致命脑疾病的变化
病毒疾病是无法治愈的,致命的神经系统疾病,可能会影响人类和动物,包括人,包括牛皮人,牛海绵状脑病(也称为疯牛病)和鹿中发现的慢性浪费病。
科学家已经花了数十年的时间来更好地了解王室如何引起这些疾病。但是,西部储备大学医学院和美国国立卫生研究院(NIH)落基山实验室的新研究将焦点介绍了如何形成王室以及如何导致不同的疾病结果。
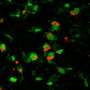
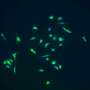
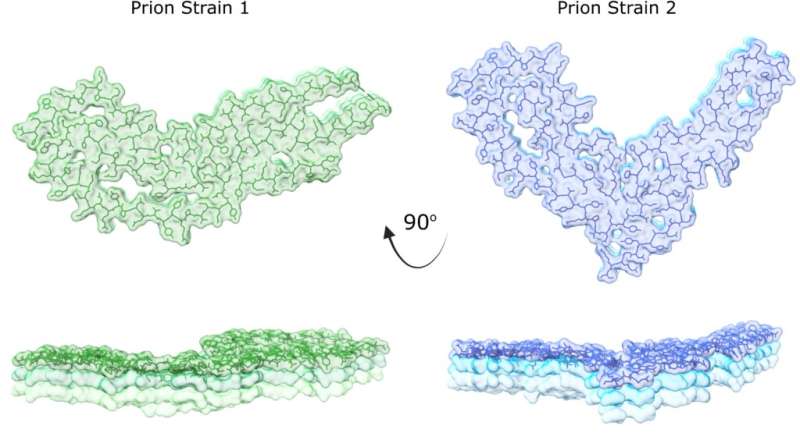
这个合作研究团队发现了一个新的王子通过革命性的新成像结构使用专业电子显微镜在克利夫兰结构和膜生物学中心冷冻电子显微镜核心和落基山实验室。新结构是第二个pr菌菌株,为腐败的pr蛋白自我转折和组装方式提供了原子水平的观点。
医学院病理学助理教授艾莉森·克劳斯(Allison Kraus)说:“王室是不寻常的病原体。不同的prion毒导致疾病的长度和症状不同。“这长期以来一直困扰科学家,因为不同的疾病因其原始形状而导致同一蛋白质的腐败发生。”
该研究于本月发表自然通讯。
克劳斯说:“我们的研究确定了王室的关键相似性和差异,以及这些特征与其他类型的自我转化蛋白相比。”“我们现在可以开始欣赏这些关键的相似性和差异如何影响prion疾病的疾病结果,并将结果与其他脑部疾病进行比较。”
当prion蛋白重新折叠时,发生prion病,导致连锁反应根据NIH的说法,其他prion蛋白会重新分配并积聚在大脑中。
克劳斯说,新的prion成像可能在理解病毒疾病结果方面发挥关键作用。
她说:“神经退行性脑部疾病非常复杂。”“有迹象表明确实确实发生了损坏的形状病毒疾病,通过进一步研究更多的prion菌株,我们可以开始了解特定的prion形状与疾病结局的关系。”