多孔细胞导致肝脏变差
在点额外的一份薯条之前,还需要另一个三思的理由吗?这可能会增加患肝癌的风险。非酒精性脂肪性肝炎(NASH)——一种脂肪肝疾病,也可能导致癌症——的病例正在上升,而治疗仍然难以实现。大阪城市大学领导的一个研究小组在抑制和治疗nash相关肝癌方面迈出了潜在的一步,他们用肥胖小鼠进行了研究,解释了肿瘤微环境中癌细胞附近细胞形成的细胞膜孔中分泌的蛋白质对癌症发展的重要性。他们的研究结果发表在科学免疫学.
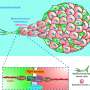
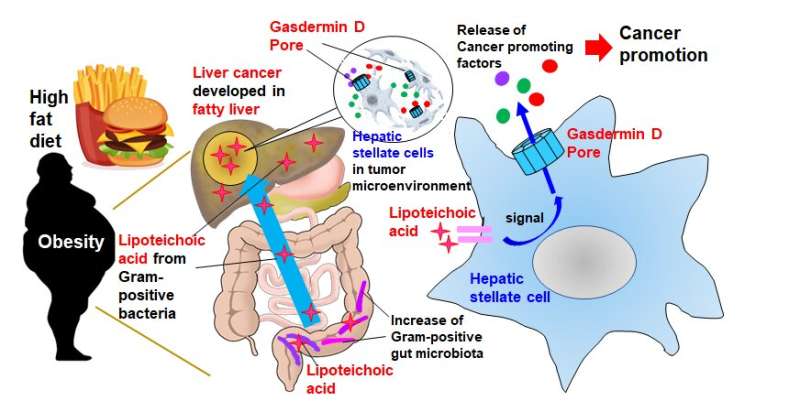
虽然癌细胞本身显然是有害的,但在所谓的“肿瘤微环境”中,包括癌症相关的成纤维细胞在内的邻近细胞也在癌症的发展中发挥作用。“在肥胖相关的肝脏中肿瘤微环境首席研究员Naoko Ohtani教授解释说:“当被称为‘肝星状细胞’的成纤维细胞开始衰老。”“这导致它们表现出一种衰老相关的分泌表型(SASP),在这种表型中,它们释放出一组通过抑制抗肿瘤免疫促进癌症的蛋白质。”诸如SASP因子等蛋白质被释放并加速肿瘤发展的机制尚不清楚。
Ohtani教授的团队试图通过喂食一种高脂肪饮食研究肥胖诱发的肝癌。他们首先进行了全面的基因表达分析,以确定哪些SASP因子是由肝星状细胞产生的,然后研究它们是如何释放的。
SASP因子IL-1β和IL-33被发现是肝癌生长的两个关键促进因子。它们的释放主要分两个阶段。“首先,高脂肪饮食削弱了肠道屏障功能,导致脂磷磷酸在肝脏中的迁移和积累,”Ohtani教授解释道。“第二,积累的脂磷选择酸刺激了gasdermin D蛋白的裂解。这进而形成了IL-1β和IL-33从肝星状细胞输出或释放的细胞膜孔。”
这些气孔起着至关重要的作用,因为一旦IL-33被释放,它就会激活其受体阳性调节性T细胞,从而抑制免疫反应来癌症细胞并可能加剧癌症的发展。
了解这一机制是人类与癌症斗争的重要进展。“我们的研究揭示了一个非常有趣的机制,促进肿瘤的SASP因子通过肠道微生物成分刺激形成的细胞膜孔释放,”Ohtani教授总结道。抑制这种孔隙的形成可能有助于nash相关的预防和治疗策略肝癌病人。”
进一步探索