一个新的突变synucleinopathies后面
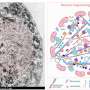
帕金森病和路易体痴呆属于一个家庭的神经退行性疾病称为synucleinopathies因为他们是病态的积累造成的神经突蛋白α-突触核蛋白结构称为路易小体和路易的大脑中。
在一个健康的大脑,α-突触核蛋白在突触不同的蛋白质称为单体。但不同的突变基因编码的α-突触核蛋白可能导致蛋白质凝结在一起,形成更大的低聚物和更大的纤维。
科学家已经识别并绘制出很多的α-突触核蛋白基因突变导致synucleinopathies,许多研究,包括从Lashuel实验室工作,显示突变也可能通过不同的机制,导致相同的病理。虽然罕见,研究这些突变导致重要的见解和帮助揭露不同的机制,有助于神经退化和帕金森病的发展。
一种新的突变
但在2020年,一项研究报道α-突触核蛋白基因新突变在路易体痴呆患者和非典型退化的额叶和颞叶。突变替代品氨基酸谷氨酸和谷氨酰胺(E) (Q)第83届蛋白质的位置氨基酸序列——这就是为什么突变叫做E83Q。区分所有先前确定的这种突变突变是位于中间的调节α-突触核蛋白正常功能的域(与细胞膜相互作用)和驱动聚合和病理学开始形成。
探索新路径
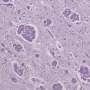
“我很好奇这个突变的独特地位和E83Q突变载体显示严重路易体病理在大脑皮层和海马区域比通常的黑质中往往是主要影响帕金森病,”希拉说Lashuel EPFL生命科学学院的。
Lashuel补充道:“这些观察结果表明,新的突变可能影响α-突触核蛋白的结构、聚合,并通过机制有别于其他致病性突变,可以帮助我们揭示小说机制将α-突触核蛋白在帕金森病神经退化和病理学的形成。”
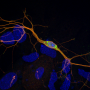
科学家与Markus Zweckstetter组在德国和弗兰克Sobott DZNE利兹大学的。他们应用一系列生化、结构和成像方法解剖这个突变如何修改不同形式的α-突触核蛋白的结构及其聚合体外性质。接下来,他们用路易体形成的细胞模型的组合来确定E83Q突变影响α-突触核蛋白的各个方面与正常功能和病理。
他们的体外研究表明,这种突变不仅大幅增加α-突触核蛋白聚集的速度也形成聚合物的结构和形态特征不同于那些与正常的蛋白质。自最近的研究表明,“这是令人兴奋的骨料的不同结构表现出的能力差异导致帕金森病小鼠模型,病理和传播可能解释的临床异质性帕金森症等神经退行性疾病,“Senthil t·库马尔说,该研究的第一作者之一。
这些结构上的差异来确定足以转化为不同的病理形成和毒性,研究人员比较了能力正常的α-突触核蛋白的蛋白质和E83Q诱导神经元模型的病理形成卢身体形成和神经退化Lashuel实验室开发的和被广泛用于识别新靶点和测试新的阿尔法-突触核蛋白靶向疗法。
”神经元播种的路易体形成模型,E83Q突变不仅极大地提高了播种活动和路易身体,就像包裹体的形成,但这也导致了多个聚合形成不同形态的多样性具有很类似于α-突触核蛋白病理学在帕金森氏症患者的大脑,“说Anne-Laure Mahul-Mellier,这项研究的第一作者。“我们很高兴看到,我们能够实现这一目标我们在培养皿中路易体模式。”
“我们的研究结果支持核心作用的α-突触核蛋白在PD的发展和其他synucleinopathies证明α-突触核蛋白聚集的结构特性的变化可能导致synucleiniopathies的神经病理和临床异质性,“Lashuel说。“因此,强调使用疾病模型的重要性,尽可能繁殖人类的多样性病理学和治疗方法能够针对病理α-突触核蛋白物种的多样性。”
下一步,Lashuel集团将验证这些发现在动物模型中使用材料隔离受影响的病人,并将进一步调查是否这种突变也会影响的正常功能α-突触核蛋白。
进一步探索