CryoEM解锁COVID-19演化的理解
弗朗西斯·克里克研究所的研究人员已经确定了的结构性变化COVID-19变异提供线索传染性的病毒进化到更高层次。
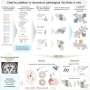
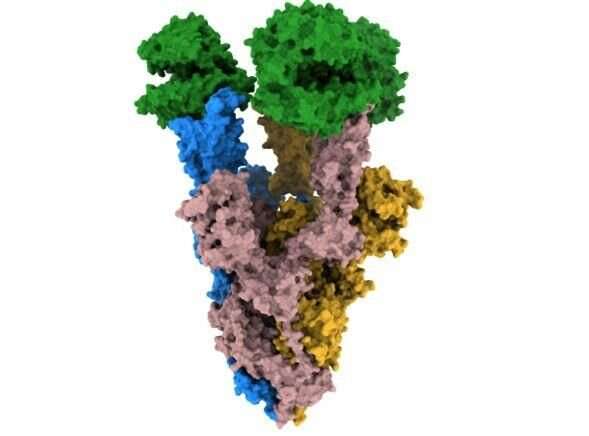
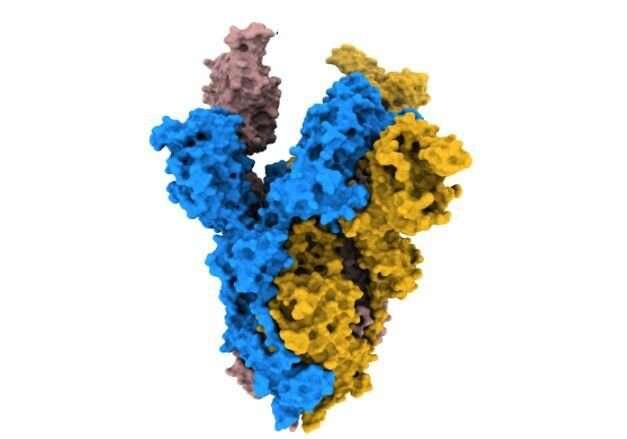
整个COVID-19大流行,SARS-CoV-2进化变异的结构差异病毒斯派克蛋白质。这一峰值变化如何影响病毒结合和感染细胞,控制传染性的一部分。
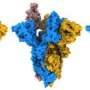
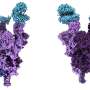
在他们的研究发表在自然通讯今天(3月4日星期五),科学家们用高分辨率低温电子显微镜确定结构的变化峰值蛋白质α和β的变异,出现在2020年的大流行。
他们发现α飙升的改变意味着它是更稳定的人类细胞受体结合,ACE2,相比原来的病毒株。这样增加的稳定性可能会使病毒的进程绑定和感染病毒的细胞更有效。
测试版有不同的替换,K417N,提出的安排至关重要的一个更加开放的形状,质数飙升的细胞受体结合。
这两个变化,导致增加稳定和更加开放的飙升形成也存在于买卖变体。
安东尼Wrobel位联席作者和博士后训练的克里克疾病过程的结构生物学实验室,说:“我们希望了解这种病毒进化的阶段经历了,这是我们看到的一些重要变化的α和β变体曾被观察到在随后的变异和未来可能出现的。”
研究人员还发现,这两个变量具有相同的替换,叫做N501Y受体结合域,这是病毒与人类细胞结合。一旦这种替换出现了与另一个叫D614G,它使病毒更强烈地绑定到细胞相比原来的病毒。为α绑定6倍和β两倍。
这个观察可以解释为什么后来变异进化从早期变体D614G替换而不是通过一个不同的进化道路。
位联席作者和博士后训练的疾病过程的结构生物学实验室克里克,唐纳德·本顿解释道:“我们的工作提出了三个通用机制,通过它的人口发展。我们可以看到关键氨基酸替换导致峰值蛋白质发展稳定增加,一个更加开放的结构,形成更强的债券的能力与人类细胞受体。这些变化帮助病毒实现更高层次的传染性,这是建立一个感染宿主的能力。”
史蒂夫•Gamblin作者和组长的疾病过程的结构生物学实验室克里克说:“SARS-CoV-2一再改变结构的病毒已经进化,增加变化如何有效的病毒在感染细胞。低温-电子显微镜提供了一个有价值的工具探索这些变化和帮助我们更好地了解基因变化与尖峰结构的变化和受体结合。”
克里克的研究者都在继续研究SARS-CoV-2,包括理解它如何影响免疫系统,和疫苗提供多少保护。
更多信息:安东尼·g·Wrobel et al, SARS-CoV-2突起蛋白在人类宿主的进化,自然通讯(2022)。DOI: 10.1038 / s41467 - 022 - 28768 - w。doi.org/10.1038/s41467 - 022 - 28768 - w