2022年1月12日功能
如何反转位子活动控制大脑
大约一半的转座因子的基因组是由元素或“跳跃基因”,源自古老的病毒集成。他们坚持各种状态的衰减就像一个老式的把自己的垃圾场,部分从旧报废车辆可以收集并使用。虽然大多数的这些序列真的是垃圾,可以找到宝藏的矿石。
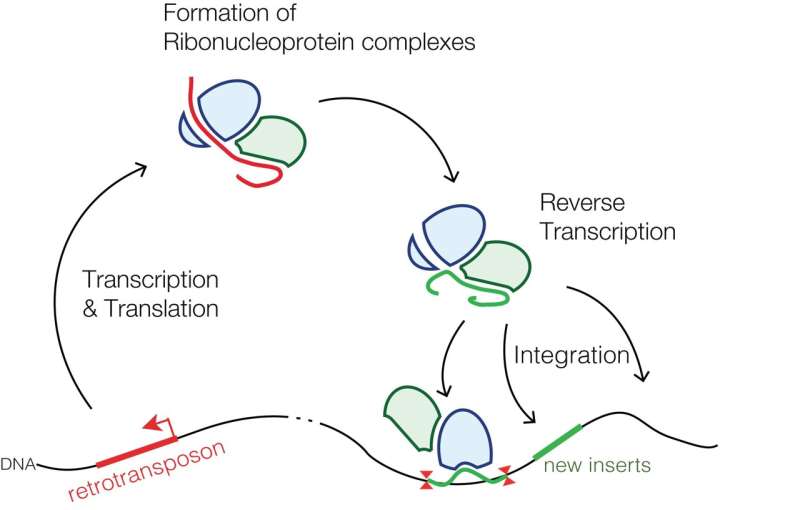
反转位子活动的哺乳动物;常见的1号线(L1)元素,例如,包含一个类的转座子盐我们的基因组遗传mini-islands十几万的曲调。这是大约20%的总序列。的几千l1仍主要是完整的,只有大约100左右保持其全部编码潜力,即。,仍然能够移动retrotransposition的基因组。这涉及到一个复制粘贴的机制使用逆转录酶中指定第二和最后的开放阅读框,通常指定为ORF2。
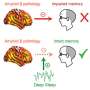
也许并不奇怪,retrotransposition事件往往是破坏性的,经常改变,甚至在某些情况下,可取的。反转位子活动有一个嗜好机会融入网站现有的DNA损伤,像,例如,在双链断裂。在最近的一次回顾发表在老化神经科学前沿研究人员描述,反转位子活动还可以更进一步,如何启动DNA损伤,损伤,事实上,似乎是许多常见和罕见的神经退行性疾病的基础。
的基本普及retrotransposition似乎让很多生物群落大吃一惊,突然,并且经常很整齐,解释他们的许多最棘手的悬而未决的问题和追求。例如,现在看来,所有(或者至少300000)基因组的重要监管增强剂及促进剂在前面genes-ultimately源自逆转录病毒插入的残余。一些人甚至提出,线粒体定位序列进化或被反转位子活动插入。此外,我们的许多传统基因现在理解来自两种普通逆转录病毒插科打诨,波尔,或者env基因参与了一个新的使用。
例如,RNaseH和整合酶域逆转录病毒波尔基因的最终服务提供成立现代免疫系统的构建块。同样,关键syncytin1蛋白质(可能有显著的序列和功能相似SARS-CoV-2现在熟悉的突起蛋白)的env基因来源于HERV-W(人类内源性逆转录病毒)ERVWE-1轨迹,并不可或缺的功能发展的胎盘。合胞体蛋白表达显著调节在多发性硬化症。它还导致星形胶质细胞在体外细胞毒性,和少突细胞损失和髓鞘脱失转基因老鼠。许多其他签名核创新,像信使rna剪接的出现,也有可能逆转录病毒的礼物。
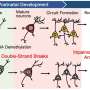
病毒主显节正式开始前一段时间,当时的想法反转位子活动基因寄生虫活动只有在进化生殖细胞(传播)弗雷德规严厉地驱散了索尔克研究所于2005年。他的团队表明,成熟的体细胞,尤其是海马的神经前体细胞,准备并愿意主机换位。估计相差很大,工作时由他的实验室和其他表明发展中神经元可能每个了十来个换位事件途中成熟。这意味着我们的大脑,可能我们的身体,明显的马赛克,邻近细胞相同的假定的表型可以有明显不同的基因组结构由于合适的换位事件。
除了这些惊人的声明是一个平行观察到更多的基因组实际上比以前转录被赞赏。而不是仅仅几个基因表达在这里或那里,研究显示,80%以上的可能转化为我们的整个基因组某种类型的RNA。一半基因的逆转录病毒增加,许多这些音标无疑是反转位子活动之一。
不用说,细胞没有采取这些病毒攻击躺着。考虑到1号线插入占至少1每250致病突变在人类疾病中,镇压retrotransposition一定已经成为一个迫在眉睫的威胁的细胞的中央关注。尤其是生殖细胞,利用自己的特殊蛋白质处理初期retrotransposition事件最脆弱的时候,在他们的基因重新启动几次。这些必要的转换发生在DNA和组蛋白甲基化模式是擦拭干净,然后重新由专门的甲基转移酶的活性。当镇压反转位子活动的甲基化是不够的,第二道防线,即小干扰rna的许多品种,是展开的。的确,这两个现在无所不在地遇到机制也可能最初进化为防御驯化的内源性病毒激活。
失败的小分子核糖核酸的保护,流氓反转位子活动处理由专用的先天免疫系统蛋白质在细胞质中以及选择性封存autophagous囊泡。这些干扰素和sirtuin防御系统的重叠与那些各种各样的检测胞质核酸从外部病毒感染,甚至导致细胞衰老或凋亡。奇怪的是,许多危险的事情(氧气想到),许多分化细胞发现retrotransposition也可以是一个强大的结盟的而细胞年轻,至少可以控制他们。神经元特别宽松的压迫时,这事情开始变得有趣的地方。反转位子活动,尤其是当他们与DNA修复机制,现在显著图到我们的许多最珍贵的精神capabilities-our珍贵的记忆,而与此同时,其恢复性睡眠。
现在似乎是如此,许多立即早期基因的转录活动的大脑是非常会增加神经活动激增假定持久记忆的形成在很大程度上离不开DNA双链断裂的形成及其后续修复。让我再说一遍:我们真的是,或者至少我们珍视再次回忆的一天,最终归结为DNA维护。上个月这条线的研究达到了戏剧性的高潮与DNA损伤的报告直接引发睡眠通过聚ADP核糖聚合酶1 (Parp1)修复途径。从这个意义上讲,双链断裂不仅是积极的参与者,而且我们可能intuit的主要组件神经过程。
这种机制关闭圆,从增加神经活动和随后的基因表达模式和水平的变化,在记忆形成DNA破坏和修复和睡眠。简而言之,这里的主要作用方式涉及到某种类型的机械驱动或搅拌基因启动子区域。例如,拓扑异构酶释放在DNA转录,扭转应力的影响变得显著的超长基因所使用的神经元。最长的转录基因是一个令人垂涎的,经常有争议的题目,但先驱包括Ube3a-ATS基因位点(> 1 mb)参与自闭症,和DMD基因相关杜氏肌萎缩症。
DMD基因长大约2100个碱基,需要16个小时抄写。注意,这是超过可能需要一些发展中神经细胞分裂。这意味着,如果细胞复制速度比他们可以完成他们的蛋白表达,还有碰撞一定会复制和转录机器。post-mitotic,成熟神经元因此快速发展和地方修复机制不依赖于复制诱导其组成修复蛋白质。值得注意的是,神经元(顺便说一下他们的线粒体),只能弱访问cell-cycle-dependent同源重组修复没有错误通常处理双链断裂通过使用一个可用的同源引用链。当修复失败在疾病或衰老,或因为其他不适当的转座子激活,我们看到了熟悉的结果。研究人员最近发现,post-mitotic神经元异常DNA复制和重新进入细胞周期,特别是在神经退化老年痴呆症等疾病。无法终止与适当的细胞分裂周期,这些神经元可能变得衰老,坚持一些未知的倍性的状态。
DNA损伤和修复的重要性是充满理解,它变得明显,竞争恢复性核苷酸在神经系统一定是残酷的。腺嘌呤核苷酸必须远离平衡态相对丰富,精力充沛的原因而鸟嘌呤nucletides必须适当地平衡他们的循环和繁殖磷酸化形式根据其信号需求。访问nucletides在合适的比例和维护水平可靠的修复和线粒体复制现在可以越来越理解是潜在的神经结构的主要组织和推动力量。许多相同的观测对DNA损伤和修复过程的普罗维登斯可能同样适用于癌症。各种细胞和细胞器都有自己的独特的套件核苷酸合成、打捞和修复蛋白质,相应地,他们喜欢核苷酸水平和密码子偏好。
也许我们目前最好的方式渗透和理解这个复杂的网络nucletide-controlling酶与基地开始,坐在DNA的临界点和RNA-what我们可以称之为thymine-uracil联系。因为聚合酶不区分deoxyUracil(主要是dUTP)和硫胺素,dUTP都可以预见到到我们的内生DNA,并到任何病毒DNA感染我们的中间体。因此我们和病毒都保留一个广泛的调色板的尿嘧啶糖基化酶迅速修复任何uracil-corrupted DNA。我们也有一个免费的阿森纳dUTP-degrading酶降低自由dUTP水平或胞核嘧啶转换他们的基地。有趣的是,同化逆转录病毒退化或演变成反转位子活动仍然常常保留尿嘧啶糖基化酶的一种或另一种形式。虽然这些药物发现现在活跃的区域,特别是抗病毒药物可能特定于外国尿嘧啶糖基化酶,这是一个相对较新的领域,还有待探索。
更多信息:Eugenie Peze-Heidsieck et al,反转位子活动作为一个来源的DNA损伤神经退化,老化神经科学前沿(2022)。DOI: 10.3389 / fnagi.2021.786897
©2022科学欧宝app网彩X网络