高度有效、稳定nanobodies SARS-CoV-2停止
哥廷根研究人员已经开发出mini-antibodies,有效地阻止冠状病毒SARS-CoV-2及其危险的新变种。这些所谓的nanobodies绑定和中和病毒比以前发达mini-antibodies高达1000倍。此外,科学家们优化mini-antibodies稳定性和耐高温。这种独特的组合让他们有前途的治疗COVID-19代理。由于nanobodies可以产生在大量的低成本,他们可以满足全球对COVID-19疗法的需求。新nanobodies目前正在准备临床试验。
抗体帮助我们免疫系统来抵御病原体。例如,分子附着在病毒和压制他们,使他们不再感染细胞。抗体也可以产生工业和管理严重病人。然后他们就像毒品,缓解症状,缩短从疾病中康复。这是惯例治疗乙肝和狂犬病。也用于治疗COVID-19患者的抗体。然而,这些分子工业规模生产太复杂和昂贵的,以满足全球需求。Nanobodies可以解决这个问题。
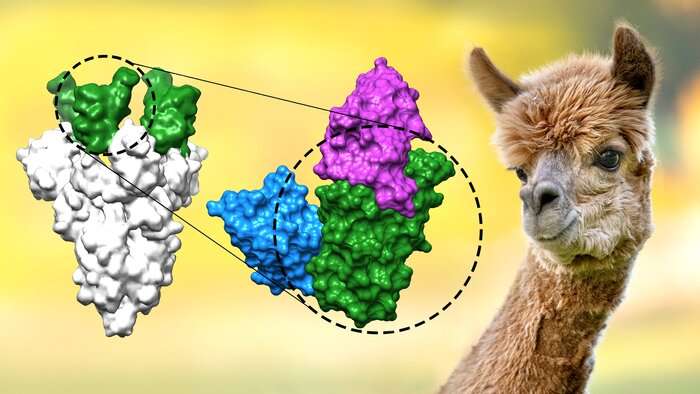
马克斯普朗克研究所的科学家们(MPI)的生物物理化学哥廷根(德国)和哥廷根大学医学中心(UMG)已经开发出mini-antibodies(也称为VHH抗体或nanobodies)团结一切所需的属性对COVID-19强有力的药物。“第一次,他们结合极端稳定和出色的功效病毒及其α、β、γ和δ突变体,“强调Dirk Gorlich, MPI主任生物物理化学。
乍一看,新nanobodies几乎没有不同于anti-SARS-CoV-2 nanobodies由其他实验室开发的。他们都是针对一个至关重要的冠状病毒峰值的一部分,病毒的受体结合域部署入侵宿主细胞。nanobodies块这个绑定域,从而防止病毒感染细胞。
“我们nanobodies可以承受的温度高达95°C没有失去功能或形成聚集,“Matthias Dobbelstein解释说,教授和主任UMG研究所的分子肿瘤学。“首先,这告诉我们,他们可能会保持活跃在体内长时间是有效的。另一方面,耐热nanobodies更容易生产,过程,和商店。”
单,双,三nanobodies
最简单的mini-antibodies由哥廷根团队开发已经包扎强烈1000倍的蛋白质比先前nanobodies报道。他们还很好地绑定到突变的α受体结合域,β,γ和δ菌株。“我们的单一nanobodies可能适合吸入,因此直接在呼吸道病毒中和,“Dobbelstein说。”此外,因为它们是非常小的,他们可以很容易穿透组织,防止病毒进一步蔓延感染部位的。”
nanobody三和弦的进一步改善绑定:研究者捆绑三个相同nanobodies根据对称的蛋白质,这是由三个相同的积木和三个绑定域名。“nanobody三合会,我们加入的力量:在理想的场景中,每个三nanobodies高度三个绑定域之一,”托马斯贪吃者报道,科学家在Gorlich团队。“这将创建一个几乎不可逆转的债券。三重不会让释放的蛋白质和中和病毒甚至高达30000倍比单一nanobodies。”Another advantage: The larger size of the nanobody triad expectedly delays renal excretion. This keeps them in the body for longer and promises a longer-lasting therapeutic effect.
作为第三设计,科学家们生产的三轮车。这些组合两个nanobodies目标受体结合域和在一起的不同部分可以结合的蛋白质。“这样的三轮车非常抗拒病毒突变和由此产生的免疫逃避的,因为他们把病毒如此强烈,”解释Metin阿克苏Gorlich研究员的团队。
对于所有nanobody variants-monomeric、双以及三倍的研究人员发现,少量足以阻止病原体。如果用作药物,这将使低剂量更少的副作用,因此,降低生产成本。
羊驼mini-antibodies提供蓝图
“我们的nanobodies源自羊驼和小的、简单的比传统的抗体,“Gorlich说。生成nanobodies SARS-CoV-2,研究人员接种三alpacas-Britta,诺拉,种子直感群在MPI的冠状病毒的生物物理化学与部分峰值蛋白质。母马然后产生抗体,科学家们画小动物的血液样本。羊驼,任务完成,所有进一步的步骤进行了酶的帮助下,细菌,所谓的噬菌体,和酵母。“总体负担我们的动物非常低,与疫苗接种和血液检测在人类中,“Gorlich解释道。
Gorlich的团队提取约十亿蓝图nanobodies从羊驼的血液。随后是例行实验室经过多年的完善:生物化学家使用噬菌体来选择最好的nanobodies最初大量的候选人。这些被测试的有效性对SARS-CoV-2和进一步提高在一轮轮的优化。
不是每个抗体的中和。Dobbelstein组织的研究人员因此决定如果以及nanobodies防止病毒在实验室培养细胞的复制。“通过测试各种nanobody稀释,我们找出哪些数量就可以实现这种效果,”解释Antje Dickmanns Dobbelstein的团队。她的同事金Stegmann补充说,“一些nanobodies真的令人印象深刻。不到1000000克每升的媒介就足以完全预防感染。在nanobody三合会,甚至另一个甚为可观稀释是足够的。”
对当前的冠状病毒变异也有效
在冠状病毒大流行,新病毒变异出现并迅速成为主流。这些变异往往比应变传染性,首次出现在武汉(中国)。他们突变突起蛋白也可以通过一些最初有效“逃脱”中和抗体的感染,恢复或接种疫苗的人。这使它更加困难甚至对于一个已经训练免疫系统消灭病毒。这个问题也会影响之前开发的治疗性抗体和nanobodies。
这就是新的nanobodies显示他们的全部潜力,因为他们也有效对抗的主要冠状病毒变异问题。研究人员已接种的羊驼突起蛋白的一部分第一个已知SARS-CoV-2病毒,但值得注意的是,这些动物的免疫系统产生抗体,对不同的病毒变异是活跃的。“我们应该nanobodies证明无效的对未来的变体,我们可以reimmunize羊驼。因为他们已经接种病毒,他们会很快产生抗体变体,“贪吃者自信地断言。
治疗应用视图
哥廷根团队目前正在准备nanobodies治疗使用。Dobbelstein强调,“我们想要测试的尽快nanobodies安全使用的药物,这样就可以对那些重病COVID-19和那些没有接种疫苗或不能建立一个有效的免疫力。”The team is supported by experts in technology transfer: Dieter Link (Max Planck Innovation), Johannes Bange (Lead Discovery Center, Dortmund, Germany), and Holm Keller (kENUP Foundation).
SARS-CoV-2的受体结合域是一个好的候选蛋白质疫苗但迄今为止难以大规模生产经济形式,激活免疫系统的病毒。细菌相应程序产生错误折叠材料。哥廷根的研究人员发现了一个解决方案,这个问题:他们发现了特殊nanobodies执行正确的折叠在细菌细胞,不妨碍关键中和受体结合域的一部分。这可能允许疫苗可以廉价地生产,可以快速适应新的病毒变异,甚至可以用简单的分布式物流小的国家基础设施。“事实上,nanobodies可以帮助蛋白质折叠以前不知道和研究和制药应用非常有趣,”Gorlich说。
更多信息:托马斯•贪吃者等中和SARS所致浸2高度有效的,应承担hyperthermostable, nanobodies和突变检测——宽容,在EMBO杂志(2021)。DOI: 10.15252 / embj.2021107985