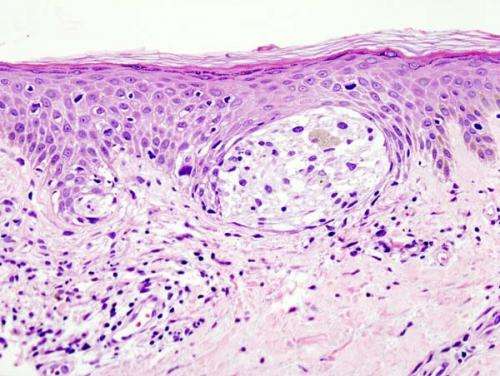
皮肤活检中具有H&E染色的黑色素瘤 - 这种情况可能代表浅表散布黑色素瘤。学分:Wikipedia/CC BY-SA 3.0
首次证明,核受体共激活因子3(NCOA3)的激活通过调节紫外线辐射(UVR)敏感性,细胞周期进程和DNA损伤反应的规避来促进黑色素瘤的发展。由Mohammed Kashani-Sabet,医学博士领导的一项临床前研究的结果,该医学中心是加利福尼亚州旧金山的Sutter's California Pacific Medical Center(CPMC)的癌症中心总监癌症研究,美国癌症研究协会杂志。
“我们的研究提出了一种先前未报告的机制,NCOA3调节DNA损伤反应并充当潜在的治疗靶点。黑色素瘤,在暴露于紫外线之后,NCOA3的激活有助于黑色素瘤的发育。学习。
流行病学研究表明,UVR在黑色素瘤因果关系中的作用,在整个基因组测序研究中证明了紫外线签名突变的高负担。但是,在UVR之后,黑色素瘤形成的精确分子机制仍然很了解,因此需要鉴定出控制紫外线和黑色素瘤敏感性的其他分子因子。
NCOA3(也称为AIB1或SRC-3)是核激素受体共激活因子家族的成员,并调节基因表达通过与各种转录因子的相互作用。NCOA3最初显示在乳房中被放大癌症,并且在各种实体瘤中表现出致癌作用。然而,NCOA3在UVR介导的黑色素作用中的作用尚未证明。
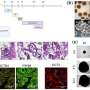
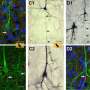
通过利用体外,体内和黑色素作用的PDX建模,Kashani博士及其同事评估了调节NCOA3表达在人黑色素瘤细胞以及黑色素细胞中的影响,并确定了黑色素瘤进展中NCOA3调节的多重致癌途径。
结果表明,通过遗传沉默或小分子抑制,NCOA3表达的下调可显着抑制黑色素瘤细胞系和PDX中黑色素瘤的增殖。NCOA3沉默抑制了心胚层色素C的表达,并提高了黑色素瘤细胞对UVR的敏感性。NCOA3表达的抑制导致DDR效应子的激活和细胞周期蛋白B1的表达降低,导致G2/M停滞和有丝分裂灾难。
一个单核苷酸多态性在NCOA3(T960T)中,与没有癌症的对照组相比,家族性黑色素瘤队列中的患病率明显低。其他研究表明,这种多态性降低了NCOA3蛋白的产生,并伴随着对紫外线的敏感性提高 - 在细胞死亡中呈现。
综上所述,这些发现与黑色素瘤起始模型一致,从而升高NCOA3表达会促进暴露于UVR后的黑素细胞存活。这种生存优势使UVR介导的DNA损伤积累。在容易患黑色素瘤的个体的一生中,对UVR的显着暴露会导致表征疾病的高突变负担和不受控制的细胞增殖。相比之下,在T960T多态性表达后,这些作用会减弱,并增加对UV介导的细胞死亡的敏感性,从而防止UVR的致癌作用。
“我们的结果表明,在肿瘤进展的不同阶段,分子标记的作用是前所未有的。这些结果将NCOA3识别为黑色素瘤的候选易感性标志物,是潜在的诊断标记,是黑色素瘤存活的预后标志物和治疗的靶标。我们提出了NCOA3在UVR介导的黑色素作用中的关键作用,并作为黑色素瘤的合理治疗靶标。” Kashani-Sabet博士说。
皮肤癌是全球最常见的癌症类型。黑色素瘤约占皮肤癌的1%,但大部分大部分皮肤癌死亡人数。今年,大约有106,000名美国人将被诊断出患有黑色素瘤。
Kashani-Sabet博士说:“我们致力于推进这项研究,以帮助指导和为治疗全球黑色素瘤和其他患者的治疗。”
研究人员确定了针对黑色素瘤的有希望的治疗剂
更多信息:David de Semir等。核受体共激活因子NCOA3调节紫外线辐射诱导的DNA损伤和黑色素瘤敏感性。癌症研究(2021)doi:10.1158/0008-5472.CAN-20-3450
期刊信息:癌症研究
由Sutter Health提供