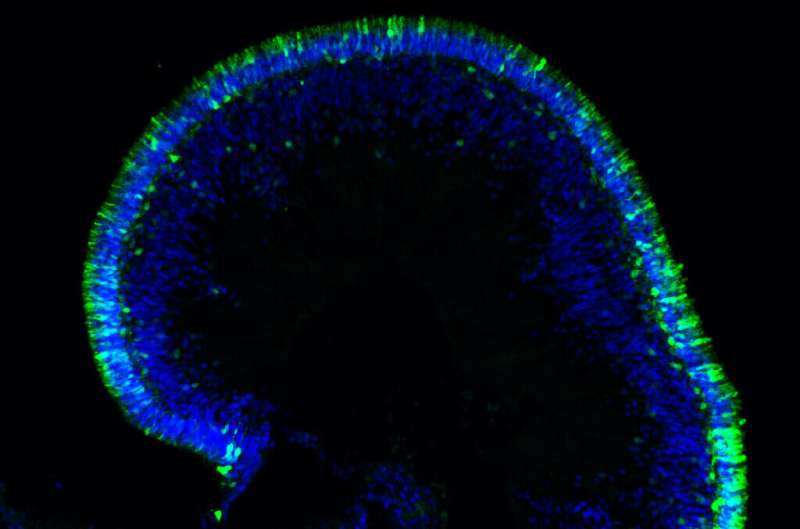
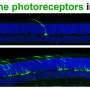
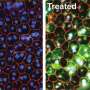
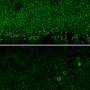
人类视网膜瀑样。资料来源:阿南德·斯瓦鲁普博士
美国国家眼科研究所(NEI)的科学家开发了一种有前途的基因治疗策略,用于治疗一种导致儿童严重视力丧失的罕见疾病。作为一种Leber先天性黑蒙,该疾病是由CRX基因的常染色体显性突变引起的,用基因治疗具有挑战性。科学家们用实验室制造的视网膜组织来测试他们的方法,该组织由病人的细胞制成,称为视网膜类器官。该方法通过在其天然控制机制下添加正常基因的拷贝,部分恢复了CRX功能。研究报告将于今天发表干细胞的报道。Nei是国家健康研究院的一部分。
“我们的治疗方法增加了正常基因的更多拷贝,可能会潜在地治疗由各种突变引起的常染色体显性LCA,”Nei神经生物学,神奇遗传和修复实验室和高级职业报告的作者。
美国食品和药物管理局于2017年批准了Luxturna,用于治疗LCA患者在称为RPE65的基因中的突变。虽然被称为基因治疗的主要进步,但Luxturna对其他形式的LCA无效,包括由CRX中的常染色体显性突变引起的那些。
CRX基因编码与DNA结合的蛋白质(也称为CRX),并指示视网膜的光感受器使叫做Opsins的光敏颜料。没有功能性CRX蛋白,光感受器失去了检测光和最终死亡的能力。
与常染色体显性LCA等疾病是棘手的,以便治疗基因治疗,因为添加更多的正常基因并不总是恢复功能。具有常染色体显性突变的人仍然具有一个基因的正常拷贝,但蛋白质的突变版本干扰了正常蛋白质。有时,而不是恢复正常功能,只需添加更多正常蛋白质可以以不可预测的方式增强疾病。
为了探讨如何增加正常基因的基因增强副本 - 将影响常染色体占优势LCA,施甘蓝队的团队,从两个志愿者和他们未受影响的家庭成员那里发育过两位志愿者的视网膜器材。由Kamil Kruczek,Ph.D.这是斯瓦努库斯实验室的博士后研究员,他们在几个阶段内建造了复杂的视网膜样组织,从皮肤细胞开始,诱导成熟的感光体和其他视网膜细胞的产生,每个阶段志愿者。正如预期的那样,患者有机体比由未受影响的家庭成员制成的有机体更少的光感感应。
为了仔细控制受体光感受器的CRX基因的表达方式,该团队重新设计了CRX启动子,因此可以用CRX基因作为基因治疗的一部分递送。启动子是控制何时何种的DNA邻序列基因表达。研究人员将基因及其工程化启动子包装在病毒内,该病毒将它们穿梭于有机体光感受器中。
该团队的基因扩增策略恢复了这两名患者的类器官CRX蛋白功能,驱动了两种类型的光感受器中视蛋白的表达:杆状体和锥状体。
斯瓦鲁普说:“这种策略对两种CRX突变都有效,这是非常令人兴奋的。”“基因扩增可能是一种可行的方法治疗对于由其他常染色体显性引起的LCA突变。"
“这个概念基因治疗study is the first step toward a potential treatment for a rare form of LCA," said Brian Brooks, M.D., NEI clinical director and co-author on the study. "It's a great example of bench-to-bedside science, when researchers in basic and clinical science collaborate."
更多信息:Kruczek K. Qu Z, Gentry J, Fadl BR, Gieser L, Hiriyanna S, Batz Z, Samant M, Samanta A, Chu CJ, Campello L, Brooks BP, Wu Z,和Swaroop A。用患者干细胞衍生的视网膜类器官治疗显性CRX-Leber先天性黑内障干细胞的报道2020年1月28日。
期刊信息:干细胞的报道
由...提供全国眼学院