诱导血管祖细胞增强缺血性血管疾病模型中的功能恢复
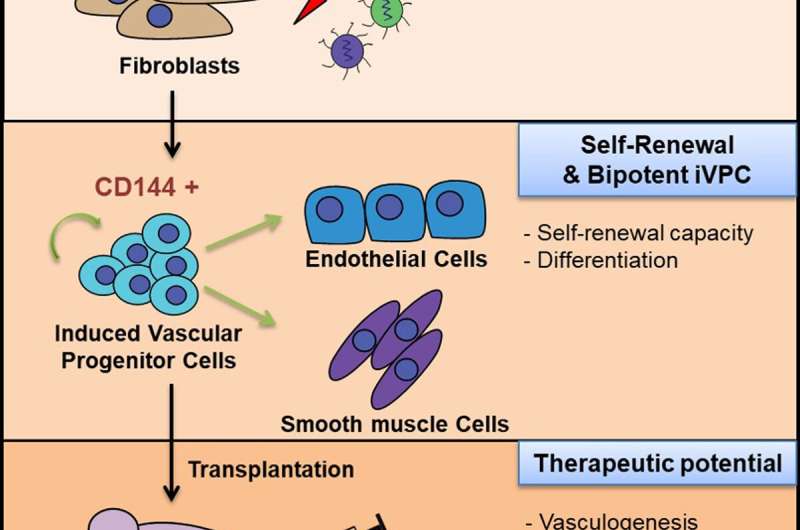
与韩国Ulsan国家科学与技术研究院(UNIST)附属的研究团队成功地通过直接血统转换产生了双向自我更新的IVPCS。
革命血管祖祖祖国细胞已经发现了用于治疗缺血性血管疾病的vpcs。这是通过直接谱系转化产生的,这不太可能在大规模细胞培养过程中引起癌症,因此可以用作3-D印刷人组织(例如心脏)所需的血管的主要原料肝。
这一突破由Jeong Beom Kim教授和他在Unist的生命科学学院的研究团队领导。在该研究中,研究小组证明了诱导的VPC(IVPCS)可以通过ETS的成纤维细胞产生(E-26)转录因素,etv2和fli1。此外,将该IVPC移植到缺血性后肢模型中增强血流量没有体内肿瘤形成,这提供了作为治疗缺血性血管疾病的治疗剂的有趣可能性。
当损坏发生时血管将血细胞,营养和氧气运送到身体的组织,缺血性血管疾病发生。细胞疗法涉及移植细胞以恢复组织或器官功能的受关注,作为缺血性疾病的潜在治疗。血管祖细胞(VPC)通过分化多能干细胞(PSC)而产生,包括胚胎干细胞并诱导PSC(IPSC)具有自我更新的能力,因此非常适合批量生产。虽然VPC被认为是对缺血性疾病治疗最强的候选者,但残留的未分化细胞可以在移植后形成肿瘤,这是将PSC衍生的VPC应用于缺血性患者的关键障碍。
Kim教授通过直接谱系转换来解决了这个问题,通过仅使用谱系限制的转录因子来诱导来自另一种谱系的功能细胞。在该研究中,研究小组证明诱导的VPC(IVPC)可以通过ETS(E-26)转录因子,ETV2和FLI1从成纤维细胞产生。
“ETV2和FLI1的两种DNA主要在血管开发的早期表达,”SOO Yong Park(C.S / Ph.D组合)。研究的第一个作者,“能源与化学工程”,“精力和化学工程”。“在这项研究中,我们证明ETV2和FLI1的异位表达足以将成纤维细胞转化为诱导的VPC(IVPC),其能够产生ECS和SMC。”
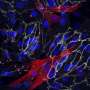
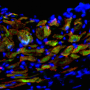
干细胞具有广泛(自我更新)和分化成其他细胞类型(生物或生物透明)的能力。在该研究中,研究团队通过直接谱系转换成功地生成了双向自我更新的IVPCS。他们还证实,IVPC可以分化为功能性内皮细胞(IVPC衍生的内皮细胞)或平滑肌细胞(IVPC衍生的平滑肌细胞)在定义的培养条件下。此外,他们观察到,移植的IVPCs增强血液流动而不在缺血性血管疾病模型中形成肿瘤形成。
“我们证明了具有自我更新和双能性的缺血性疾病可治愈IVPC,可以通过强制ETS系列转录因子,ETV2和FLI1表达来源于小鼠成纤维细胞,”Kim教授说。“我们的研究可以促进未来的动脉粥样硬化治疗申请。”
此次重放的调查结果已在期刊上发表动脉硬化,血栓形成和血管生物学。
进一步探索









用户评论