美国食品药物管理局(FDA)允许首次在家中进行快速病毒检测
周二,美国监管机构允许紧急使用第一种冠状病毒快速检测,这种检测完全可以在家里进行,30分钟内就能得出结果。
美国食品和药物管理局(Food and Drug Administration,简称fda)的这一宣布标志着美国努力将COVID-19检测选项扩大到医疗设施和检测场所之外的重要一步。然而,这项测试需要处方,可能会限制其最初的使用。
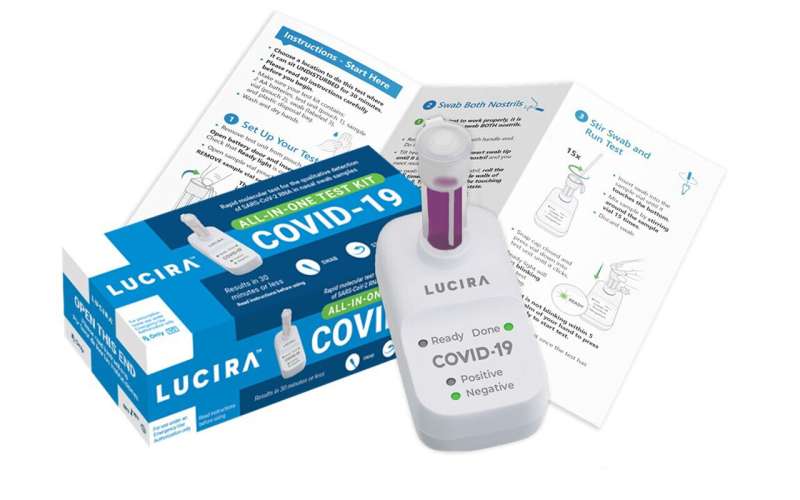
FDA紧急批准了Lucira Health公司的一次性检测试剂盒,Lucira Health是一家加利福尼亚的测试开发商。
该公司的检测允许用户用棉签擦拭自己的鼻子来收集样本。然后将样品放入装有实验室溶液的小瓶中,并插入便携式设备中进行旋转。结果以标记为阳性或阴性的灯显示。
到目前为止,FDA已经批准了近300项冠状病毒检测。绝大多数需要卫生专业人员进行鼻拭子检测,并且必须在实验室使用高科技设备进行处理。有一些测试可以让人们在家里收集自己的样本——用鼻拭子或唾液——然后运到实验室,这通常意味着要等好几天才能得到结果。
卫生专家呼吁允许人们在家进行自我检测,减少周转时间,减少病毒向其他人(包括卫生保健工作者)传播的可能性。快速检测结果对于快速隔离感染者和追踪其接触者至关重要。但几个月来,由于测试实验室的瓶颈,美国的测试一直受到结果缓慢的困扰。还有其他快速检测方法,但大多数需要由卫生专业人员操作的小型特殊机器来提供结果。
FDA设备中心主任杰夫·舒仁(Jeff Shuren)博士在一份声明中表示:“现在,更多可能感染COVID-19的美国人将能够根据研究结果立即采取行动,保护自己和身边的人。”

Lucira表示,预计这种测试的价格为50美元,并将于明年春天在全国范围内推出。
据该公司网站称,Lucira COVID-19检测源自该公司为开发一种家用流感检测而进行的研究。Lucira公司成立于2013年,在疫情爆发后采用其技术检测COVID-19。
该检测使用的技术与基于基因实验室的检测类似,是COVID-19筛查的标准工具。这与美国目前使用的大多数快速检测方法不同,后者寻找的是被称为抗原的病毒蛋白质,而不是病毒本身。它们在检测病毒方面的准确性通常低于基于实验室的测试。
Lucira说,在筛查该病毒时,其检测结果与基于实验室的检测结果相符的比例为94%。
FDA在发布会上说,任何使用该测试呈阳性的人都应该隔离并寻求健康专业人士的治疗。检测结果为阴性但仍有冠状病毒症状的人应咨询医生;阴性结果不排除感染COVID-19的可能。
FDA表示,Lucira的测试也被授权在医生办公室和测试场所使用。目前,美国所有的检测地点都必须向追踪疫情的州和联邦卫生当局报告结果。医生将被要求报告家庭测试结果。
FDA检测办公室前负责人Alberto Gutierrez博士在公告前的一次采访中说:“如果没有报告结果,可能很难弄清楚在整个社区发生了什么。”

几个月来,20多家公司一直在为开发首个新型冠状病毒(COVID-19)的快速家用检测方法而赛跑。然而,FDA为制造商概述了一些研究要求。
这些障碍与COVID-19无关,更多的是几十年来对没有接受过任何医疗培训的人能否准确地进行筛查并解释结果的担忧。
美国食品和药物管理局只批准过一种用于传染病的家庭测试——艾滋病毒测试。甚至是普通的非处方测试——比如家用怀孕工具——在FDA于20世纪70年代允许使用之前,也要经过多年的审查。
专家表示,对于冠状病毒,谨慎的做法是必要的。
梅奥诊所(Mayo Clinic)的罗宾·帕特尔(Robin Patel)博士在宣布这一决定之前接受采访时说,“我认为,未来的发展方向是在患者更近的地方增加检测,包括在家里进行检测。”“但为了确保安全有效地完成这项工作,必须考虑到一些因素。”
美国食品和药物管理局(FDA)的监管人员利用他们的紧急权力授权了这项新测试,以便在公共卫生危机期间快速提供实验产品。在正常情况下,FDA在批准一项新测试之前需要有安全性和有效性的证据。但在突发公共卫生事件期间,如果检测的好处似乎大于其风险,该机构可以降低这些标准。
美联社。保留所有权利。未经允许,本材料不得出版、广播、改写或重新发行。











用户评论