与疾病相关的错综复杂的蛋白质建筑
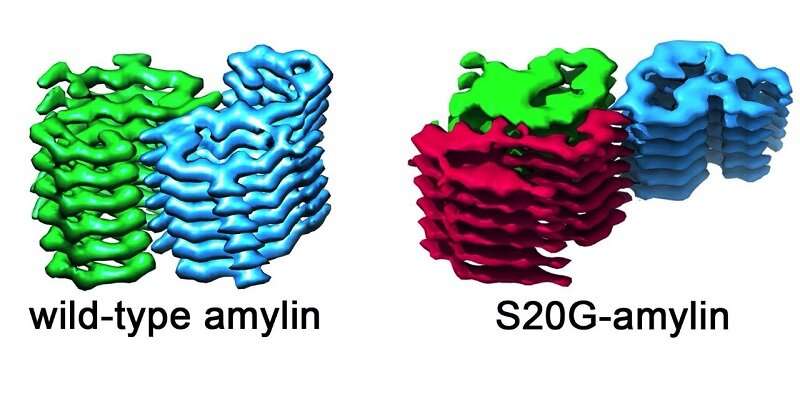
科学家们首次鉴定了与早起2型糖尿病的蛋白质纤维的结构。
淀粉蛋白是调节身体葡萄糖水平的蛋白质。这种小肽激素可以聚集或聚集在一起形成淀粉片原纤维(纤维状结构体)。这些聚集体是2型糖尿病的标志 - 尽管科学家们尚未完全了解如何淀粉样蛋白形成导致疾病。
的形成淀粉样蛋白原纤维也与其他疾病联系在一起,包括神经变性障碍Alzheimer,帕金森和亨廷顿疾病。
在今天发表的研究中自然结构和分子生物学,利兹大学的科学家报告说,他们已经能够使用最新的淀粉素原纤维的结构电子显微镜技术 - 并且已经发现了他们怀疑的架构使一些淀粉蛋白序列更容易形成淀粉蛋白聚集体比其他淀粉蛋白聚集体:与2型糖尿病的早期发作相关的特征。
他们比较了从大多数人口中发现的淀粉蛋白类型的淀粉素原纤维 - 科学家称之为野生型 - 并将其与具有早起2型糖尿病的人观察到的遗传变异。
通过分析成千上万的图像,它们能够可视化淀粉蛋白分子骨料如何聚集成原纤维,形成复杂的结构,其中淀粉蛋白分子在梯子中堆积起来,并描述将原纤维保持在一起的详细相互作用。
图像显示,由野生型和S20G版本的淀粉蛋白形成的原纤维是不同的。所有的野生型原纤维每次伴有两个淀粉蛋白。对于一些S20G原纤维而言,这也是如此,它们也发现了一种形式的S20G原纤维,每层具有三个淀粉素原纤维。这表明原纤维可以形成模板,淀粉蛋白可以锁定的更多副本。
这可以解释为什么S20G变体蛋白蛋白质更快地聚集并且与疾病的更快速发作相关。
尼尔·兰森,利兹大学结构分子生物学结构分子生物学和Astbury Centrology副主任,联合了该项目。他说:“这是一个非常令人兴奋的结果,因为它揭示了一种巨大的聚集体可能形成的机制,并且在理解疾病过程中至关重要。
“我们知道这种情况发生在疾病中,但我们从来没有明确地理解它是如何发生的。现在,通过这些结构,我们正在获得第一次瞥见可能正在发生的事情。”
Sheena Radford Frs,Astbury Biophysics和Astbury Center主任教授和该研究的联合领导,补充说:“我们知道S20G蛋白质的聚集更快,这项研究提供了理由,为什么可能是案件的理由。这是重要的,而不仅仅是为了了解淀粉蛋白 - 而是了解许多粘连症,其中发生掉掉的原纤维形成。“
研究人员使用了冷冻电子显微镜技术来揭示原纤维的结构。将蛋白质样品冷冻,然后在电子显微镜中分析至可以看到单个原子的分辨率。
电子显微镜在Astbury Biostructure实验室内,是2016年建立的主要国际研究中心,其中包括利兹大学和惠康信托的资金。
诸如本作作品中呈现的淀粉样蛋白结构的知识可以通过定制治疗依赖于的定制治疗来铺平更好的诊断和治疗淀粉样蛋白疾病的方式原纤维类型形成。
拉迪福德教授补充说:“这只是寻找新方法的行程的开始疾病在新的强大方法之前是不可能的电子显微镜开发了。“
进一步探索















用户评论