2020年8月24日功能
控制组织再生与三维生物打印的时空定义模式的生长因子
一个来自爱尔兰、荷兰和美国的生物医学工程、机械工程和生物力学的研究团队最近开发了3d生物打印植入物,这些植入物经过生长因子的优化以促进移植血管生成-血管生长来自现有的血管和骨形成-新骨生长。在这项工作中,Fiona E. Freeman和他的同事们功能化了纳米颗粒的生物墨水来打印具有不同生长因子模式的植入物,并注意到体内血管生长(血管生成)的速率是如何依赖于这种表达的血管内皮生长因子(VEGF)。他们注意到,在含有梯度VEGF的植入物中,血管入侵的水平高于那些含有相同数量的VEGF蛋白的植入物。打印的植入物保持了VEGF的梯度,并结合空间定义骨形成蛋白(BMP)定位和释放动力学,以加速大的骨缺损愈合和最小的异位骨形成,即非骨性组织的异常骨生长。这项工作有潜力的生物打印生长因子点护理治疗和在生物医学应用严格控制的组织再生。
用于治疗的生长因子
研究人员在临床试验中测试了多种生长因子用于不同的治疗应用,包括骨再生和新血管形成或新血管形成。尽管有很好的结果,但一些二期试验的结果还没有显示出来对患者的预期益处有些人甚至证明了这一点明显不良反应。生长因子通常在骨折愈合的不同阶段表达,包括血管内皮生长因子(VEGF)和骨形态发生蛋白(BMP)。为了获得最佳的结果,科学家已经开发了两种生长因子(VEGF和BMP)的联合疗法来加速大骨缺损的再生。在骨折愈合, BMP-2的表达水平通常持续上升,直到第21天,而VEGF的表达峰值更早。因此,他们开发了支持VEGF早期释放和BMP-2持续释放的给药系统。在这项工作中,Freeman等人使用多工具生物制造技术递送具有不同释放谱的VEGF和BMP-2,以改善严重大小的骨缺损的再生。
团队控制了形态因子他们用海藻酸盐为基础的生物墨水,嵌入不同的纳米颗粒来结合调节因子。他们在构建物中减缓BMP-2的释放,以增强植入物预定位置的体内骨形成,以加速骨愈合,同时最小化异位骨形成。Freeman等人使用粘土纳米颗粒或羟磷灰石纳米粒子用海藻酸-甲基纤维素制成的生物墨水来促进VEGF的可控释放。他们展示了这种结构是如何在生物打印后的实验室中维持生长因子的空间梯度至少14天的。
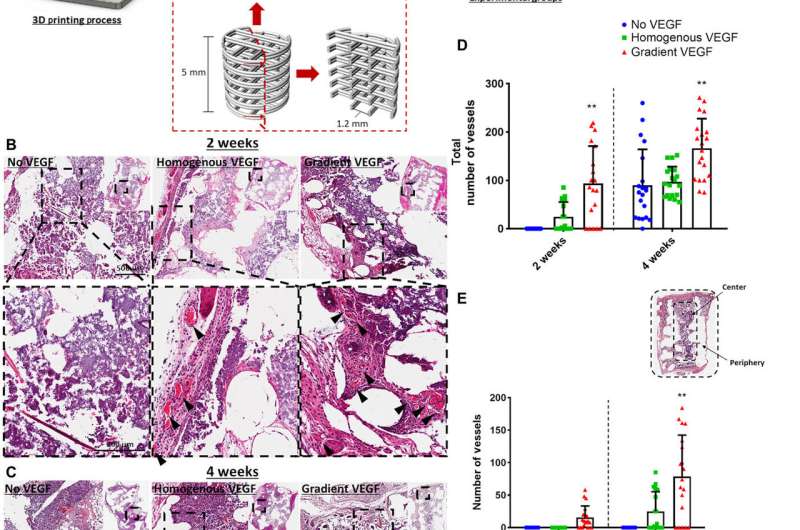
打印的VEGF构建物增强了体内血管生成,该团队通过将构建物放置在3d打印中进行了测试聚已酸内酯(PCL)植入加速小鼠模型血管形成。在动物模型皮下植入后2周,他们进行组织学分析发现VEGF均质组和梯度组中存在血管。无VEGF组未见明显血管。在2 - 4周之间,VEGF梯度组外周受限血管显著增高,Freeman等人注意到构建体中的血管生长成熟和完整。
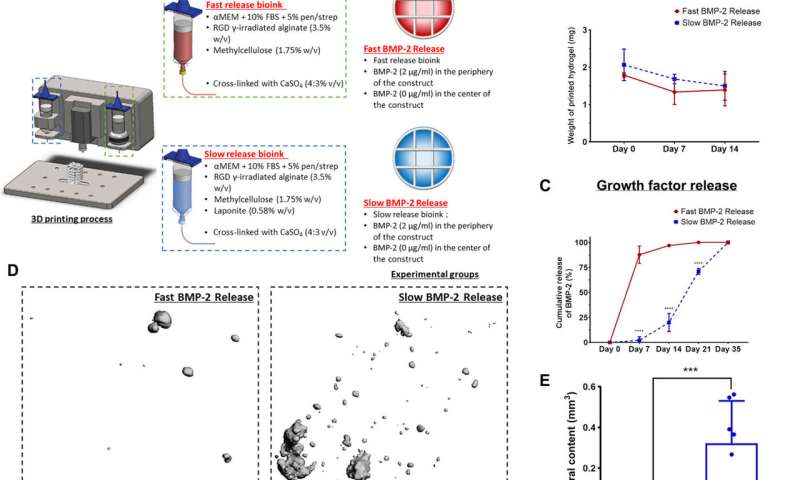
因为众所周知BMP-2的缓慢和持续释放有助于最佳的骨再生该研究小组在一所大学进行了骨形成研究小鼠模型生长因子在特定的时间范围内释放。Freeman等人补充说,为了显著减少生物墨水中BMP-2的释放laponite(一种纳米药物平台),并在实验室中监测其持续释放一至四周。为了了解在动物模型中对骨形成(成骨)的影响,科学家们构建了快速释放BMP-2(不含拉脱石)和缓慢释放BMP-2(含拉脱石)的生物墨水,并将生物墨水与骨髓间充质干细胞(BMSCs),并将其放置在3d打印支架中。然后,他们将这些支架植入小鼠背部皮下,并在此过程中添加额外的种子间充质干细胞检测异位部位的骨骼生长。定量研究显示,BMP-2的缓慢释放可显著增加每个构造的总面积的新骨形成。该研究还显示,BMP-2的缓慢释放使每个结构的总面积具有显著更多的新骨形成潜力。
增强大骨缺损内血管生成
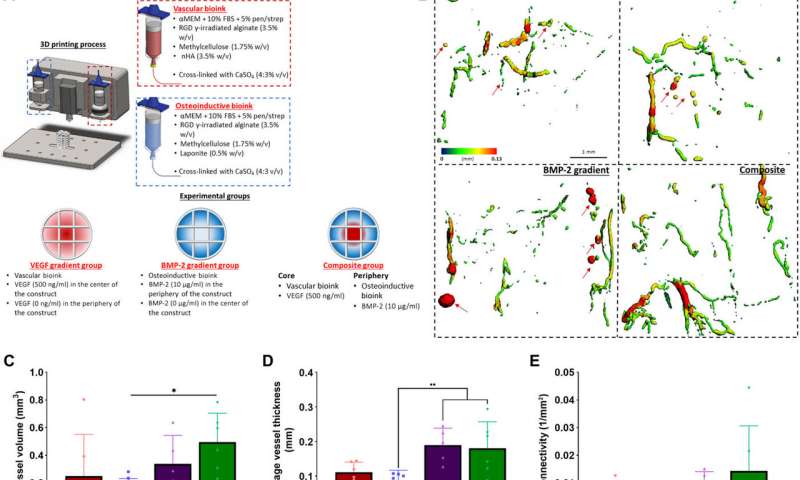
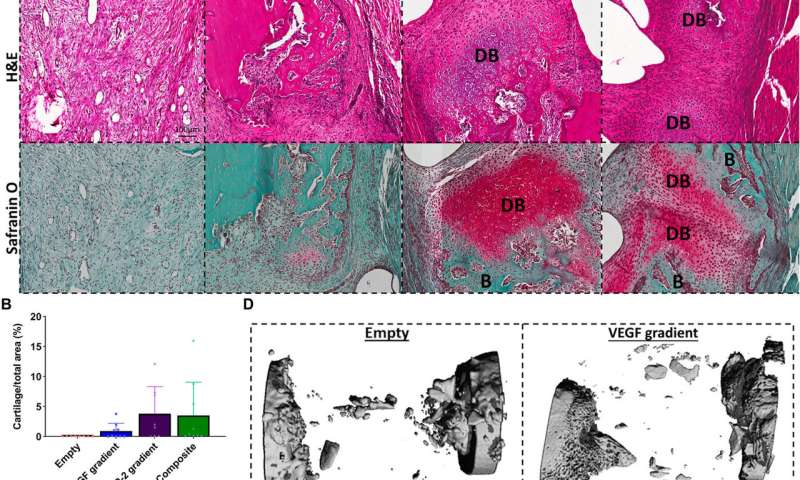
Freeman等人接着证明了时空传递生长因子(VEGF和BMP-2)来增强血管生成。使用含有VEGF空间梯度的缓释BMP-2构建,他们记录了增强骨形成和血管生长临界大小的大鼠股骨缺损。植入后两周,微型电脑断层扫描(micro-CT)血管造影显示本研究中使用的所有实验组的血管网络的外观,以及原始的未成熟血管,在不同的实验构建之间有显著差异。术后2周,他们还发现BMP-2梯度和复合实验组软骨和新骨染色阳性。当他们进行微ct测试以了解骨形成时,他们发现了一致的愈合模式。植入后12周内获得的骨密度对比图显示,新骨包含的皮质样骨与邻近的原生骨相似。为了研究异位骨形成,科学家们在重建12周时对一个感兴趣的区域进行了骨体积分析,在所有实验组中,骨优先在缺损环内形成,很少有异位骨形成。另外的组织学染色显示纤维组织,骨髓和软骨的主要形成。
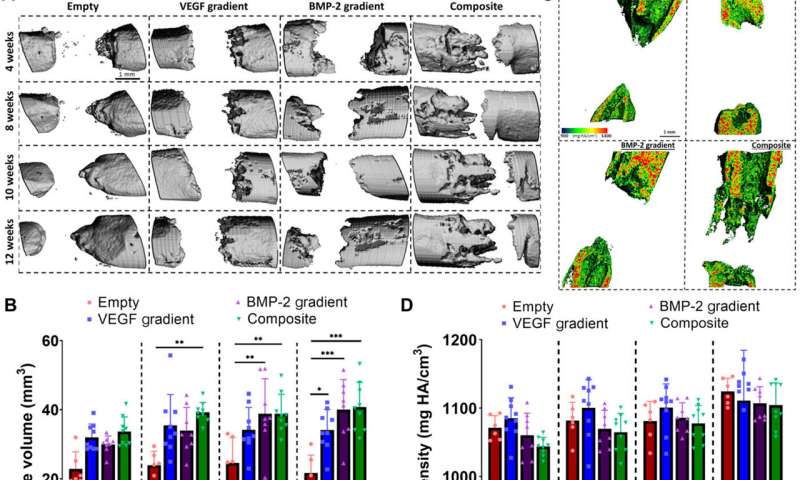
通过这种方式,Fiona E. Freeman和他的同事开发了带有生长因子的3d打印种植体,其中最理想的包括VEGF与BMP-2结合的空间梯度,以增强大骨缺损的愈合和很少的异位(异常)骨形成。研究小组通过使用极低浓度的外源性药物实现了骨愈合反应的增加生长因子。下一步将包括将这种组织工程技术从实验台上转化到床边,这是一个具有挑战性、昂贵和耗时的过程。这项工作中详细介绍的方法是一种前所未有的策略,允许时空生长因子的递送来再生大的骨缺损或增加任何3d打印结构的血管化。该团队展望了这种技术在不同组织类型控制再生方面的未来应用。
进一步探索
Michael Simons等人。治疗性心血管疾病的血管生成自然评论药物发现(2003)。DOI: 10.1038 / nrd1226
Zarana S. Patel等人。在一个临界大小的缺损模型中,血管生成因子和成骨生长因子的双重传递,骨(2008)。DOI: 10.1016 / j.bone.2008.06.019
©2020 S欧宝app网彩cience X Network














用户评论