深入心脏:揭示心脏细丝结构和功能
大阪大学的研究人员使用电子冷冻显微镜(CryoEM)以前所未有的分辨率对心脏肌肉的基本成分(被称为细丝)进行成像。他们还发现了这些细丝在钙离子存在或不存在时通过心肌收缩通过改变其构象来调节心脏跳动的机制。这项工作可能应用于开发新的药物,用于治疗由影响这些结构和功能的突变引起的心脏疾病。
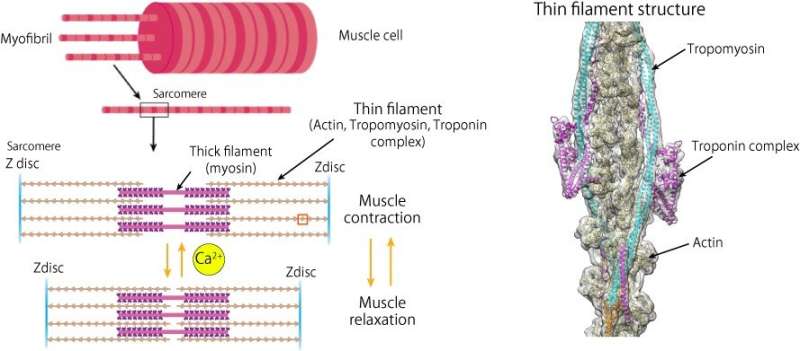
的人类的心脏是一种非凡的器官,能够终生不停地泵血。然而,其内部工作的许多细节仍然未知,部分原因是其肌肉蛋白质在自然形态下的确切结构难以想象。对于细丝(由肌动蛋白、肌钙蛋白和原肌凝蛋白组成的微小丝状结构)来说尤其如此,这是由于它们之间复杂的相互作用和较小的体积。人们早就知道,心肌收缩是由体内钙离子浓度的反复增加和减少控制的肌肉细胞而收缩的控制是通过这些离子与细丝结合时细丝结构的变化来完成的。然而,确切的机制尚不清楚。
现在,通过使用CryoEM,大阪大学的研究人员揭示了迄今为止这些蛋白质的最高分辨率的结构图像。传统的电子显微镜通常会损坏脆弱的生物样本,这意味着它们在体内的原始形状无法确定。相比之下,通过cryoEM技术,样品被快速冷冻,因此蛋白质可以在仍处于其原生构象时进行成像。
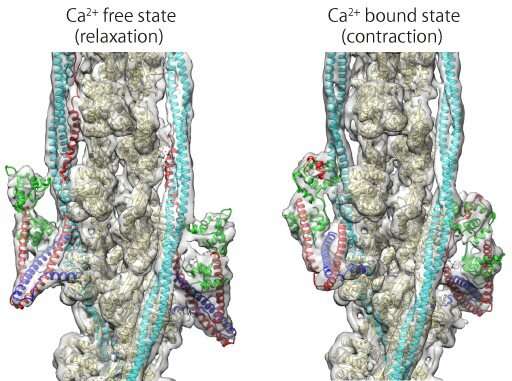
“揭示细丝的整个结构非常困难,但我们成功地解决了它结构使用cryoEM和先进的图像分析,”第一作者Yurika Yamada说。大阪大学的研究小组展示了在缺乏钙离子的情况下,肌凝蛋白进入肌动蛋白区域的途径是如何被阻断的,因此肌凝蛋白头无法附着在肌动蛋白区域上进行肌肉收缩。然而,钙离子的结合改变了细丝的构象,暴露了收缩的附着位点。
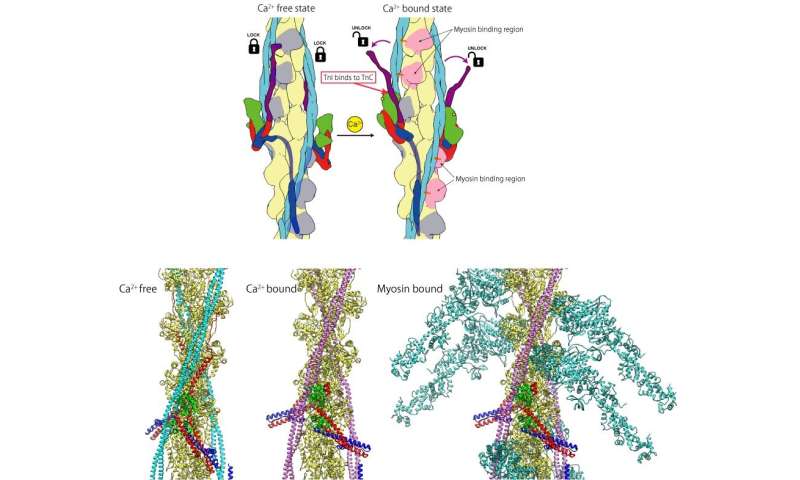
“因为已知细丝的组成蛋白质中的许多突变会导致心脏病,包括心脏肥大以及心肌病,所揭示的结构可以为新型药物设计提供分子和结构基础,”资深作者藤井隆和南巴圭一解释说。
这项研究还强调了cryoEM揭示以前未见过的解剖细节的力量,具有尚未想象到的医学突破的潜力。
文章,“心肌薄。灯丝结构揭示钙的调节机制,”发表在自然通讯.
进一步探索