结构分析揭示了一种癌症药物的意外机制
帕尔巴科尼霉素在临床上批准用于治疗乳腺癌,但根据一项新的研究,药物效率背后的分子机制不是科学家们认为是什么。
在12月13日公布的新发现,UC Santa Cruz的化学和生物化学教授Seth Rubin表示科学,出现了他团队对蛋白质分子结构的研究药物与之互动。
“这对于理解为什么某些癌症会对帕博昔布产生抗药性以及为什么会产生抗药性非常重要乳腺癌细胞可以造成抗抵抗力,“鲁宾说,这篇论文的相应作者。”它解释了药物的机制,让人们思考设计更好地克服抵抗的新药。“
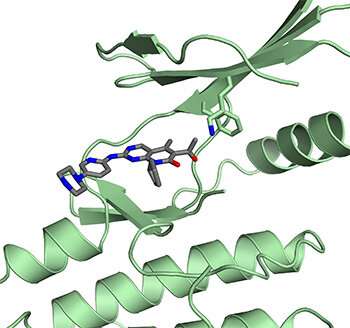
鲁宾的实验室专注于一种名为CDK4(一种周期蛋白依赖性激酶)的蛋白质,它能驱动细胞增殖通过与其他蛋白质合作以灭活视网膜母细胞瘤蛋白(RB)。RB是一种分子门守,其在其活性形式中,阻止细胞通过细胞生长和分裂的循环进入。
Palbociclib(以及相关药物ribociclib和abemaciclib)被设计成靶向CDK4并阻止其灭活Rb。这些药物是通过对纯化的CDK4复合物和激活它的蛋白质(称为细胞周期蛋白d)进行测试而开发出来的。鲁宾对第三种蛋白质p27感兴趣,p27也参与调节CDK4。因此,他的团队用CDK4、细胞周期蛋白D和p27确定了整个三蛋白复合体在细胞中发生的结构。
“当我们用p27解决这个结构时,我们惊讶地发现,药物似乎无法与它结合,”Rubin说。“所以我们对它进行了测试,果然,这种药物不能结合,也不能使它失去活性蛋白质复合体p27。”
进一步研究使用乳腺癌细胞产生更多的线索,以至于药物实际在做什么。结果表明,除了抑制活性CDK4复合物,帕尔巴克测杆菌单独结合CDK4并防止其与细胞周期蛋白D和P27形成活性络合物。然后这导致抑制不同的细胞周期蛋白依赖性激酶CDK2,使其阻止其失活。
鲁宾解释说:“因此,这种药物不仅阻止了CDK4的组装,还间接抑制了CDK2。”“当癌症细胞造成阻力,往往是因为他们开始调整CDK2活动。“
进一步探索






用户评论