研究人员优化SCD和Beta Thalassemia的基因编辑

丹娜-法伯/波士顿儿童癌症和血液疾病中心(Dana-Farber/Boston Children’s Cancer and Blood Disorders Center)和马萨诸塞大学医学院(University of Massachusetts Medical School)的研究人员开发了一种治疗两种最常见的遗传性血液疾病——镰状细胞病和地中海贫血的策略,将CRISPR-Cas9基因编辑应用于患者自身的血液干细胞。本周在自然医学并在1月份的报告中在杂志中血液他们的方法克服了先前的技术挑战,比过去更有效地编辑血液干细胞。
这两项研究表明,经过基因编辑的细胞产生了经过基因修正的细胞红细胞生产功能血红蛋白。
“我们认为我们的工作定义了一种策略,可以治愈常见的血红蛋白疾病,”Daniel Bauer医学博士说,他是Dana-Farber/Boston Children’s的主治医师,也是这两篇论文的资深作者。结合基因编辑和自体干细胞移植可能是一种治疗镰状细胞病那beta-thalassemia和其他血液疾病。“
根据世界卫生组织(World Health Organization)的数据,镰状细胞病和地中海贫血症每年影响全球33.2万例受孕或分娩。这两种疾病都涉及球蛋白基因的突变。在地中海贫血中,这种突变会阻止红细胞产生足够的携氧血红蛋白分子,从而导致贫血。在镰状细胞病中,突变导致血红蛋白改变形状,使红细胞扭曲成僵硬的“镰状”形状,从而阻塞血管。
更有效的编辑
这自然医学研究使用了CRISPR-CAS9技术,特别是由Scot Wolfe,Ph.D的团队修改的Cas9蛋白。在Umass Medical School,优化基因编辑。在以前的尝试编辑人血液干细胞和祖细胞的基因组,一旦细胞在骨髓中嵌入骨髓中的效率,特异性和长期稳定性都是变化的。新技术提高了编辑的目标和耐用性。
“高效地编辑血液干细胞种群 - 理想地以接近100%的速率 - 对于实现持久的是至关重要的治疗效果马萨诸塞大学医学院分子、细胞和癌症生物学教授Wolfe说。“通过科学界多个实验室的贡献,这一目标已经取得了进展。我的研究团队与鲍尔实验室合作,专注于提高CRISPR-Cas9技术的递送和核进入效率,以实现几乎完全的治疗性编辑整个血液干细胞群体。”
鲍尔的团队利用这一策略进行了一次高度针对性的编辑。波士顿儿童医院先前的研究表明,失活一种名为BCL11A的基因可以使红细胞在出生后继续产生胎儿形态的血红蛋白。胎儿血红蛋白不呈镰刀状,可以代替有缺陷的“成人”血红蛋白。最近,Bauer发现了一个更安全的目标:BCL11A的基因增强器,它只在红细胞中活跃。
“通过我们的新的高效协议,我们可以在几乎所有的内容编辑BCL11A Enhancer造血干细胞我们收集,克服了编辑这些细胞的一些技术挑战,”鲍尔说。“在我们的实验中,95%以上的增强子序列的副本以一种我们预计将具有治疗效果的方式进行了改变。”
该策略使携带镰状细胞病患者血液干细胞的小鼠产生具有足够胎儿血红蛋白的红细胞,以防止细胞镰状细胞病。研究小组发现,经过基因编辑的细胞被注入血液后,又被移植到骨髓中,产生了经过基因修正的红细胞。后来,当从这些老鼠身上分离出血液干细胞并移植到其他老鼠身上时,这些细胞再次被移植,仍然携带治疗基因变化。
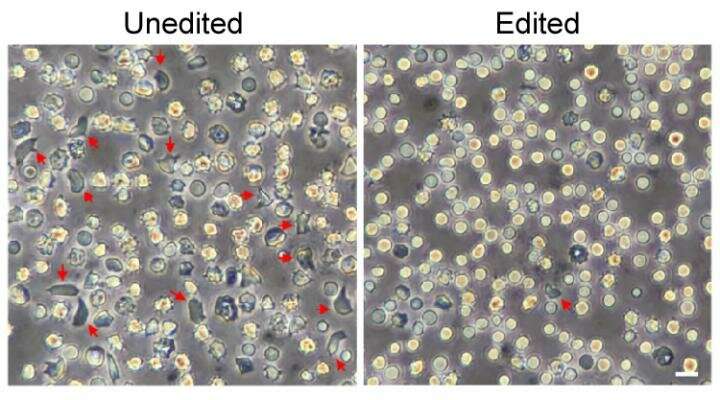
应用于来自β-地中海贫血患者的血液干细胞,相同的策略恢复了血红蛋白的正常平衡。
另一项研究发表在血液,使用类似的基因编辑方案来靶向β-地中海贫血的形式,其涉及在β-珠蛋白基因附近的DNA中的剪接突变误差,这些β-珠蛋白基因改变基因如何读出以组装β-珠蛋白蛋白。在这项研究中,迄今为止βThalassemia患者捐赠了它们的细胞,其在盘中被操纵。对于一些患者来说,Umass团队产生了不同的酶,Cas12a,以更有效地靶向它们的突变。CRISPR系统有效地对来自每一个患者的血细胞β-珠蛋白蛋白的正常剪接进行了编辑和恢复正常剪接。
为临床试验做准备
调查人员正在采取措施将他们的BCL11A增强者编辑战略带到诊所。他们正在开发一种临床级,扩大的细胞产品制造方案,并对FDA进行监管批准所需的安全性研究。他们计划从全国心脏,肺和血液研究所的治疗镰刀细胞倡议寻求资金,在患者发起临床试验。
丹娜法伯/波士顿儿童医院已经开始了基因治疗的临床试验镰状细胞病。这种方法通过暴露患者的血干来增加胎儿血红蛋白的产生细胞到一种携带敲除红色的BCL11A基因指令的慢病毒血液-Cell前体。
鲍尔认为,保持这两种方法都很重要。他说:“这些情况是非常常见的遗传疾病,在世界上资源相当有限的地区尤其常见。”“所以我们需要广泛的治疗选择,让尽可能多的患者获得治疗。”
Yuxuan Wu和Dana-Farber /波士顿儿童的景王是一首作者自然医学纸;鲍尔是通讯作者。Dana Farber/Boston Children's的徐淑倩是第一作者血液纸;鲍尔和沃尔夫是共同通讯作者。
这项工作得到了波士顿儿童医院转化研究项目、美国国立卫生研究院(NHLBI, NHGRI, NIAID, NIGMS, NIDDK)、蓝鸟生物、哈佛干细胞研究所、圣Jude儿童研究医院合作研究联盟、Burroughs Wellcome基金、美国血液学学会、多丽丝·杜克慈善基金会、查尔斯·h·胡德和库利贫血基金会。
波士顿儿童医院(Boston Children’s Hospital)持有蓝鸟生物(bluebird bio)的股权,几位作者已经申请了与治疗性基因编辑相关的专利。
如果正在研究的技术被证明是有益的,波士顿儿童医院可能会获得经济利益。与所有研究一样,医院已经并将继续采取一切必要措施,以确保研究对象的安全,以及本次研究获得的信息的有效性和完整性。
















用户评论