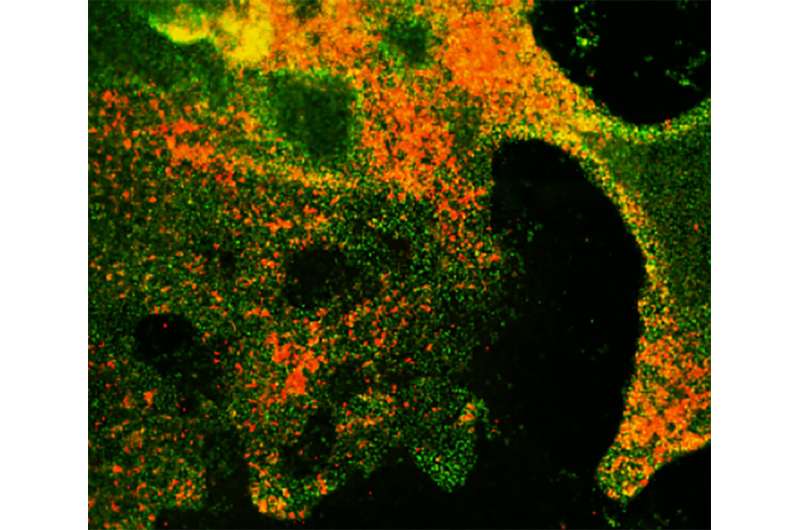
当RB基因和缺口信号通路都被抑制时,肺祖细胞(绿色)形成增加的神经内分泌细胞(红色)。信贷:陈等, 2019
来自Weill Cornell Medices的研究人员使用人胚胎干细胞来创造一种新的模型系统,使他们能够研究小细胞肺癌(SCLC)的开始和进展。这项研究将于2月8日出版实验医学杂志,揭示了两种关键肿瘤抑制基因所扮演的不同角色,这些肿瘤抑制基因通常在这些高度致命的癌症中常见。
SCLC是一种极具侵袭性的肺癌,几乎只在吸烟者中发现,通常在几个月内对现有的治疗方法(如化疗和放疗)产生耐药性。在过去的30年里,在开发治疗这种疾病的新疗法方面进展甚微,导致美国国会和国家癌症研究所将其列为“顽疾”癌症。
缺乏新治疗的一个原因是SCLC的快速发作和进展,使得难以获得研究人员学习的临床样本。在过去几年中,研究SCLC的模型已经在老鼠中开发。新报告的作者杰姆描述SCLC学习的替代方法人体细胞的增长胚胎干细胞在培养中把它们分化成各种类型的肺细胞能够癌变。
SCLC被认为从特定类型的肺细胞发展,称为肺部神经内分泌细胞(PNEC),但直到现在,没有人知道如何诱导人胚胎干细胞在实验室里成为PNECs“我们发现了一种方法诱导肺neuroendocrine-like细胞培养的人类胚胎干细胞首先区分成肺部祖细胞后,“欢欢乔伊斯说,梅尔癌症中心的博士后研究员,威尔康奈尔医学,他是这项研究的主要作者之一。“我们通过阻断一种被称为NOTCH的重要细胞信号通路来做到这一点。”
几乎所有的SCLC患者携带突变,使两个关键失活肿瘤抑制基因称为RB和TP53。Chen和他的同事们发现肺祖细胞形成了更多的PNECsRB基因除NOTCH信号通路外被抑制。此外,RB- 缺点pnecs表达了一组非常类似于早期SCLC肿瘤表达的基因,尽管当注射到实验室小鼠时,它们不能形成肿瘤。
但是,当陈和同事也抑制了TP53PNECs开始表达基因这是推广细胞增殖并预防细胞死亡,并且当在小鼠的皮肤下注射时,含有这些pnecs的培养物形成缓慢生长的肿瘤。结果表明突变中的突变RB和TP53影响SCLC起始的两个方面。
“我们的系统应该能够进一步研究这些早期肿瘤发展为侵袭性sclc(类似于患者中发现的更具侵袭性的癌症),”该研究的共同主要作者、威尔康奈尔医学院路易斯·托马斯大学教授Harold Varmus说。如果是这样,应该可以进行测试细胞在肿瘤发育的不同阶段,对易感性和对治疗策略的抵抗力。“
更多信息:陈等人,2019。J. Exp。Med.。DOI: 10.1084 / jem.20181155
期刊信息:实验医学杂志
由...提供洛克菲勒大学出版社