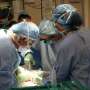
作者(左起)Jon Larson博士、Lawryn Kasper博士和Suzanne Baker博士揭示了H3 K27M突变如何影响DIPG的发育。该小组建立的实验室模型对DIPG的未来研究非常重要。来源:圣犹大儿童研究医院
圣裘德儿童研究医院的科学家们已经绘制出了异常生物机制的影响,这种异常生物机制导致了一种叫做弥漫性内在脑桥胶质瘤(DIPG)的致命脑癌。这项研究包括开发一种基因工程小鼠,这将为进一步了解这类脑癌提供方法,以及开发更有效治疗方法的实验室模型。
研究结果今天发表在该杂志的网络版上癌细胞。Suzanne Baker,Ph.D.,St. Jude发育神经生物学和脑肿瘤研究部门主任,是高级作者。
DIPGS是可治愈的脑干肿瘤,在美国每年占据数百名儿童的辐射和化疗的治疗主要是无效的,肿瘤的儿童少于10年以上。
虽然许多癌症出现突变在直接驱动异常细胞增殖或存活的基因中,其他诸如DIPG的其他诸如细胞的“表观遗传”机制的异常,用于管理基因活化或表达。
Baker和Jinghui Zhang,Ph.D.计算生物学椅系,是在大多数Dipg病例中发现表述机械中称为H3 K27M的关键突变的研究人员。
“目前还不清楚这是如何转化为基因表达调控的变化的,”她说。“我们真的完全不清楚为什么这种突变在这种疾病中具有致癌作用。”
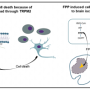
H3 K27M突变产生的基因中,该基因代码被称为A的分子组蛋白。组蛋白用作“智能包装”,用于基因压实DNA,以适合细胞核的狭窄空间,并影响基因是否被激活或保持不活性。
“其中一个最大的神秘之一是为什么在脑干胶质组织和孩子们在脑干的脑脊液中选择性地看到这种突变,当H3组蛋白在包装身体中的每种细胞中的DNA中都很重要时,”贝克说。
为了分析突变的效果,研究人员遗传地设计了一种小鼠的菌株,使科学家可以选择性地接触同一型脑细胞中的突变,这会产生人类癌症。研究人员设计了小鼠,使得突变基因以与人Dipgs相同的水平表达。
对小鼠的研究揭示了突变如何导致DIPG的关键细节。首先,突变会引发不成熟细胞称为神经干细胞在脑发育的特定时间内增加它们的干细胞活性。Baker说,该发现有助于解释为什么Dipgs发生在儿童中,脑大脑仍在开发。
科学家们还发现了H3 K27M突变如何与已知有助于驱动DIPGS的其他基因突变协同作用。一个突变导致损失“制动”的细胞增殖,称为p53。另一个突变触发了称为PDGFRα的细胞生长“促进剂”的过度激活。结合突变显着增加了小鼠中脑肿瘤的形成。
“在我们的模型中,我们诱导了这种突变,让它在整个中枢神经系统中表达,然后我们让真正的生物学向我们展示哪些细胞最容易成为。肿瘤当发生这种突变时,“贝克说。
令研究人员惊讶的是,当H3K27M突变和其他两种突变一起在整个大脑中被诱导时,它加速了脑干肿瘤的形成。
重要的是,当与病理椅子的联合作者David埃尔森,M.D.,Ph.D.,病理椅系比较了小鼠肿瘤与人的DIPG同行,他发现它们与彼此紧密相似。
贝克说,经过改造的老鼠非常有用,因为它们反映了不同肿瘤中常见的突变。
她说:“当你比较来自人类的DIPG样本时,这些肿瘤之间存在如此之多的差异,很难清楚地读出K27M突变改变了基因表达的哪一部分。”“这个老鼠模型让我们得以做到这一点,而这在使用人类肿瘤时是不容易做到的。”
已知H3 K27M突变引起表观遗传变化,其除去与沉默基因相关的信号,但它没有引起所有沉默基因打开。相反,研究人员表明,突变引起了增加的表达基因与具有特异性表观遗传签名称为“二价促进剂”的发展相关联的发育揭示了与许多其他癌症突变不同的重要作用机制。
“了解如何影响异常的外延蛋白酶可以影响基因表达,并且在许多不同的肿瘤类型中引发癌症是重要的,”贝克说。
新的鼠标模型还将提供一种测试DIPGS新疗法的重要方法。
更多信息:Jon D. Larson等人。组蛋白H3.3 K27M加速自发性脑膜胶质瘤,并驱动二价基因表达的受限变化,癌细胞(2018)。DOI:10.1016 / J.CCELL.2018.11.015
期刊信息:癌细胞
由...提供圣裘德儿童研究院