免疫细胞有助于老肌肉像新的
Duke大学的生物医学工程师已经发现了一种来自成年肌肉 - 免疫系统的自愈肌肉组织的关键组成部分。预计小鼠的发现是在研究退行性肌肉疾病中发挥重要作用,并增强未来细胞疗法应用中的工程组织移植物的存活。
结果在线出现在线10月1日自然生物医学工程。
2014年,由Duke的生物医学工程教授领导的本集团由杜科医学工程教授首次进行了初步的自我修复,实验室成长的骨骼肌肉。它有力地挛缩,迅速整合到小鼠中,并证明了在实验室和动物内部愈合的能力。
通过从大鼠的肌肉样品取出两天的大鼠,去除细胞,并将它们“种植”它们完全量身定制,以帮助他们增加来实现的里程碑。除了三维脚手架和大量的营养素之外,这种环境还支持形成利基肌肉干细胞,称为卫星细胞,可在损伤后激活并帮助再生过程。
然而,对于具有人体细胞的潜在应用,肌肉样品主要来自成人供体而不是新生儿。在成年期,许多退行性肌肉疾病都没有出现,并且在实验室中生长肌肉以测试这些患者的药物反应将受益于患者自己的成人细胞的使用。
只有一个问题 - 实验室制造的成人肌肉组织与新生儿组织没有相同的再生潜力。
“我花了一年的探索方法,从成年大鼠样本中探索伤害后的成人大鼠样品,”Bursac的博士博士生在博尔萨克的博士生,既有原创和新的研究一样。
“添加了各种药物和生长因素,已知有助于肌肉修复几乎没有效果,因此我开始考虑添加可能对伤害和刺激肌肉再生反应的支持细胞群,”Juhas说。“这就是我想起的方式巨噬细胞,免疫细胞需要肌肉在我们身体中自我修复的能力。“
巨噬细胞是身体免疫系统中的一种白细胞。从希腊语翻译为“大饮食”,巨噬细胞吞噬和消化细胞碎片,病原体和其他任何他们不认为的任何东西都应该悬挂在围绕,而分泌因子也支持组织存活和修复。
经过肌肉损伤后,一类巨噬细胞出现在场景上,以清除留下的残骸,增加炎症并刺激免疫系统的其他部分。他们募集的细胞之一是第二种巨噬细胞被称为M2,其降低炎症并鼓励组织修复。虽然这些抗炎巨噬细胞以前用于肌肉治疗疗法,但他们从未被整合到旨在在身体外部种植复杂的肌肉组织的平台。
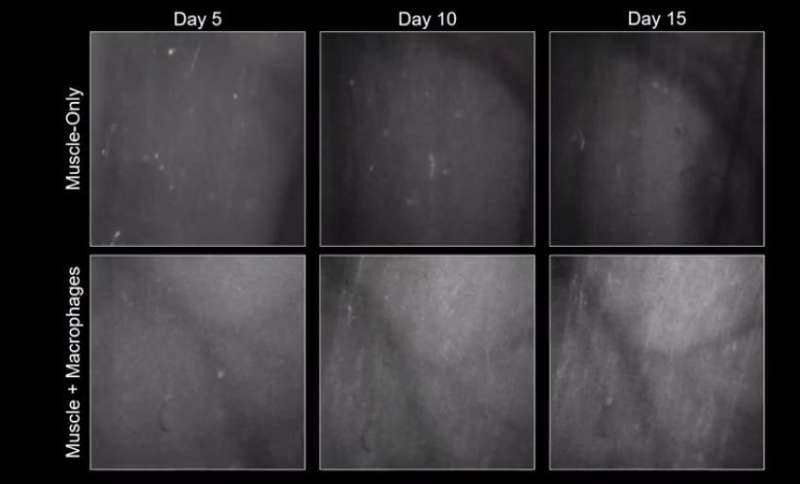
它需要几个月的juhas工作,以弄清楚如何将巨噬细胞纳入系统。但是,一旦他这样做,结果就会发生巨大变化。新的肌肉组织不仅在实验室中表现得更好,它们在嫁接成活小鼠时表现得更好。
“当我们用毒素损坏成人衍生的工程肌肉时,我们没有看到功能性恢复和肌肉纤维不会破产,”Bursac是Duke的再生联合主任下一倡议。“但在我们添加肌肉中的巨噬细胞后,我们有一个哇片刻。肌肉在15天内延长了15天,几乎就像在受伤前那样签约。这真的很棒。”
成功似乎主要来自作用的巨噬细胞,以保护受损肌肉细胞免受凋亡编程的细胞死亡。虽然新生儿肌肉细胞自然抵抗扔毛巾的冲动,但成年肌肉细胞需要巨噬细胞来帮助他们通过初始损坏而不进入细胞死亡。这些存活的肌肉纤维然后为肌肉干细胞提供“支架”,以锁定以进行再生职责。
Bursac认为,发现可能导致新的潜在再生疗法研究。根据一种受欢迎的理论,由于初始供应,胎儿和新生儿组织比成年组织更好组织- 类似于M2巨噬细胞的巨噬细胞。作为个体年龄,这种原始的巨噬细胞供应是由来自骨髓和血液的更少的再生和更多的炎症巨噬细胞所取代。
“我们认为,我们的工程化肌肉系统中的巨噬细胞可能表现得更像是肌肉植物巨噬细胞人,”Bursac说。“我们目前正在努力了解这是否确实如此。然后,人们可以设想”培训“巨噬细胞,在我们这样的系统中更好地治疗,或者通过遗传修饰增强它们,然后将它们植入患者的受损地点。”
当然,这项工作仍然是未来的阶段。虽然本研究表明,人类巨噬细胞支持实验室生长的大鼠肌肉的愈合,并且在Bursac组中的单独工作已经增长了含有巨噬细胞的复杂人肌肉,但尚未成为这种方法的再生能力的好实验室或动物系统可能在人类中。
“建立一个测试这些平台来测试这些结果在工程的人体组织中是一个明确的下一步,”Bursac说。“沿着同一条线,我们希望更好地了解植入后工程肌肉中巨噬细胞在其血管化和支配后的潜在作用。我们希望我们用免疫系统补充实验室生长的肌肉的方法细胞将证明是在未来的再生疗法中增强其他实验室种植组织的生存和功能的一般策略。“
进一步探索













用户评论