修改现代主鼠标模型的主模型

如果一种新的抗癌药物在培养皿中显示出前景,下一步通常是在小鼠身上测试药物的效果。这个系统往往对直接针对癌症的药物有效,但对免疫疗法无效。这是因为来自人类癌症样本的肿瘤只能在免疫系统受到抑制的小鼠体内生长。免疫疗法激活免疫系统对抗癌症。在一个免疫系统被抑制的小鼠模型中,没有免疫系统被激活来对抗癌症。
应对这一挑战的一个办法是努力创造“人性化”小鼠。基本上,人类免疫系统和人类肿瘤一起被移植到小鼠体内。一个真正人性化的鼠标该模型将允许研究人员测试免疫疗法指导人类免疫系统对抗人类的能力癌症...在一只老鼠身上。
不幸的是,老鼠倾向于抵制人性化。
这个过程有点像骨髓移植用于治疗白血病。通常,化疗或放疗被用来破坏病人的血液系统,然后从骨髓中生长出一个新的(非癌变的)血液系统干细胞来自一个健康的捐赠者只是,当研究人员用类似的方法删除和替换小鼠的免疫系统时,结果是暗淡无光——只有少量的免疫系统人体免疫细胞填充小鼠骨髓,很少有免疫的细胞在肿瘤附近循环,很少有免疫细胞能穿透肿瘤。
今天发表在杂志上的一项研究分子致癌作用描述了朝着更完整的人源化小鼠模型的重大进展。通过使用人类造血干细胞和祖细胞(HSPCs),而且间充质干细胞(MSCs)在小鼠体内播种人类免疫系统,研究人员能够培养出更忠实地代表人类免疫系统状况的免疫系统,从而在这些模型中获得更真实的免疫治疗测试结果。
“这两种细胞我们都需要。HSPCs产生T细胞和B细胞等血细胞;间充质干细胞似乎可以帮助骨髓产生更多的血细胞,以及其他类型的细胞,如巨噬细胞和成纤维细胞。我们从人体移植中了解到,免疫系统的这两个方面是相互合作的。现在,当我们将人类免疫系统移植到小鼠体内时,我们看到了类似的情况,”安东尼奥·吉米诺医学博士说,他是科罗拉多大学癌症中心头颈部癌症临床研究项目主任,盖茨再生医学中心成员,以及科罗拉多大学医学院丹尼尔和珍妮特·莫迪凯癌症干细胞研究捐赠主席。
研究中使用的干细胞是从捐献的脐带血中纯化出来的,然后在实验室中培养到足够的数量,然后注入小鼠体内。
“没有完美的模型,所有的模型都有局限性,但努力推动这一领域向前发展是很重要的。有时你会触地得分,有时你只是一次走1码。这项研究描述了许多这样的一码跑,因为我们多年来一直在逐步学习,”j·杰森·莫顿博士说,他是CU医学院肿瘤内科的助理研究教授,也是该论文的第一作者。
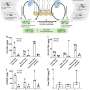
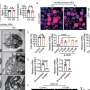
与仅移植HSPCs的小鼠相比,同时使用HSPCs和MSCs产生的小鼠骨髓中人类免疫细胞的百分比几乎是其两倍。增加的骨髓免疫细胞反过来产生9- 38倍高水平的成熟人体免疫细胞在血液系统中循环。和免疫细胞不仅在血液循环中增加,而且在肿瘤内部丰富。具体来说,用这种方法培养的小鼠肿瘤中的T细胞、B细胞和巨噬细胞比单独用HSPCs培养的模型高2-8倍。
“在一天结束的时候,你想用这些模型生成的是一个允许你提出问题的系统,”医学博士、博士、CU癌症中心研究员、盖茨再生医学中心约翰·盖茨癌症干细胞生物学捐赠主席王晓静说。
有趣的是,正在进行的工作使研究小组能够在三种情况下比较免疫系统与肿瘤的相互作用,即2014年之前可用的小鼠模型,今天可用的小鼠模型,以及最初捐赠肿瘤样本的患者。现代小鼠更精确地匹配了原始患者的肿瘤,免疫治疗导致了良好人源化小鼠的肿瘤消退(但不适用于人源化小鼠)老鼠植入同一病人的肿瘤)。
Jimeno说:“我们已经意识到,当我们使用这种双重移植时,在小鼠身上生长的肿瘤更忠实地代表了我们所知道的原始患者肿瘤的样子。”
该小组现在正致力于将他们的人性化小鼠模型更进一步,使用肿瘤样品和血液干细胞来自同一个病人。如果成功,该模型有一天可以让医生预览免疫疗法如何对特定患者起作用,指导治疗决策。