获得抗鳞状细胞癌背后的分子机制的洞察力
卡泽瓦大学的研究人员报告Embo报告关于调节鳞状细胞癌细胞命运的新分子机制。鳞状细胞癌(SCC)是由皮肤,食管,子宫颈和头部和颈部组织的分层上皮内引起的致死性癌症。SCCS的基因组分析确定了TP63高达30%的肿瘤的基因组扩增,其MRNA在大多数SCC中的过度表达。
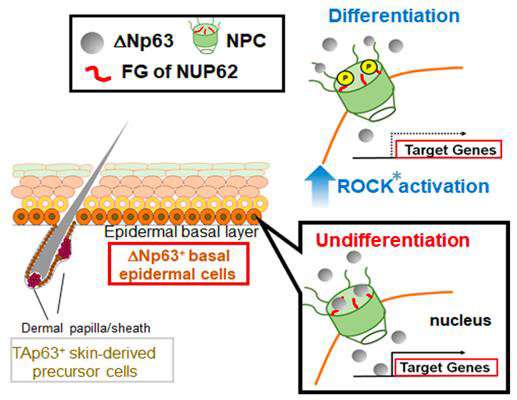
由TP63编码的蛋白质之一,称为ΔNP63α,在上皮开发和维护中具有重要作用。在SCCS中,ΔNP63α用作不同基因亚群的关键转录调节器,以维持或增强恶性表型。但是,控制机制核运输该蛋白质,截至目前,尚不清楚。
核磁素(NUPs)是蛋白质建筑物的家族核心孔隙(NPC)和调解核运输跨越核信封。最近的证据表明某些NUPs的细胞类型特定功能;然而,NUPS在SCC生物学中的意义仍然是未知的。
在本研究中,Hazawa等人。表明一种特定的核致核蛋白,核偶姻62(NUP62)在分层鳞状上皮细胞上高表达,并且在SCC中进一步升高。他们进一步证明NUP62的耗尽抑制增殖和增强SCC细胞的分化,表明NUP62是预防SCC的表皮分化所必需的。保持未分化状态的损害能力与Δnp63α核传输中的缺陷有关。最后,它们取消掩蔽了细化的交通机制,通过降低NUP62和ΔNP63α之间的相互作用来抑制Δnp63α的核传输的详细的交通机制。
本研究表明,SCCS通过ΔNP63α核运输的NUP62调节蜂窝命运的作用。但是,这些NUP是否调节不同组织中的细胞同一性(或其他类型的癌症细胞)仍然是一个开放的问题。随着作者评论的论文:“我们发现NUP62的可转换贩运活动突出了该癌基因核运输治疗靶向的潜力。”
进一步探索













用户评论