FDA批准eculizumab用于广泛性重症肌无力
昨天,美国食品和药物管理局(FDA)批准eculizumab用于抗乙酰胆碱受体(AChR)抗体阳性的成人重症肌无力(gMG)患者的治疗。
James F. Howard Jr.医学博士,神经肌肉疾病特聘教授,神经学、医学和相关健康学教授,北卡大学医学院神经肌肉疾病科主任,是3期重获研究的首席研究员。这使得FDA批准该药物用于治疗这种慢性衰弱性神经肌肉疾病。这是60多年来fda批准的首个治疗gMG的新疗法。
“我很高兴FDA认可了Soliris对抗achr抗体阳性gMG患者的益处的全面临床数据,”Howard说。“令人兴奋的是,对现有疗法没有充分反应的患者现在将有一个新的治疗选择,临床研究显示,可以改善患者的症状,他们进行日常生活活动的能力和他们的生活质量。”
在3期重获研究及其正在进行的开放标签扩展研究中,eculizumab证实了抗achr抗体阳性gMG患者的治疗益处,这些患者先前免疫抑制治疗失败,并继续遭受未解决的重大疾病症状,包括行走困难、说话困难、吞咽和呼吸。这些患者疾病恶化和危机的风险增加,可能需要住院和重症监护,并可能危及生命。这类患者约占MG患者总数的5- 10%。
2017年10月20日,星期五,由《柳叶刀神经病学。
Eculizumab是由Alexion Pharmaceuticals,Inc。制造的,并以索马里人的名义出售。
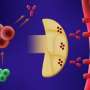
作为免疫系统的一部分,补体系统的长期不受控制的激活在抗achr抗体阳性的gMG患者的衰弱症状和潜在的危及生命的并发症中起着重要作用。通过选择性和有效地抑制末端补体级联,eculizumab针对疾病的一个关键潜在原因。
重症肌无力(MG)是一种衰弱性、慢性、进行性自身免疫性疾病神经肌肉疾病这种情况可能发生在任何年龄,但最常见的情况是女性在40岁之前,男性在60岁之后。它通常始于控制眼睛和眼睑运动的肌肉无力,通常会发展为更严重、更广泛的形式,即所谓的gMG,伴有头部、颈部、躯干、四肢和呼吸肌肉无力。
虽然大多数gMG患者可以通过目前的MG治疗得到控制,但10%至15%的患者对MG的多种治疗无效或不能耐受,并继续遭受严重的肌肉无力和限制功能的严重疾病症状。这些患者可能会出现言语不清、哽咽、吞咽障碍、视力复视或模糊、致残性疲劳、需要辅助的行动不便、呼吸短促和呼吸衰竭发作。并发症、病情恶化和肌无力危机可能需要住院和重症监护病房,住院时间延长,并可能危及生命。
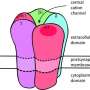
在抗AChR抗体阳性的MG患者中,身体自身的免疫系统会产生针对AChR的抗体。AChR是一种位于神经肌肉接点(NMJ)的肌肉细胞上的受体,神经细胞利用它与这些神经控制的肌肉进行通信。这些抗体与AChR的结合激活了补体级联,这是免疫系统的另一部分,导致NMJ肌膜的局部破坏。结果,神经和肌肉之间的通讯受损,这反过来又会导致失去正常肌肉函数。
在所有MG患者中,AChR抗体阳性的gMG患者约占5- 10%,尽管目前的MG治疗方法,但仍会继续遭受严重的疾病症状和并发症。










用户评论