两个A群链球菌基因与食肉细菌感染
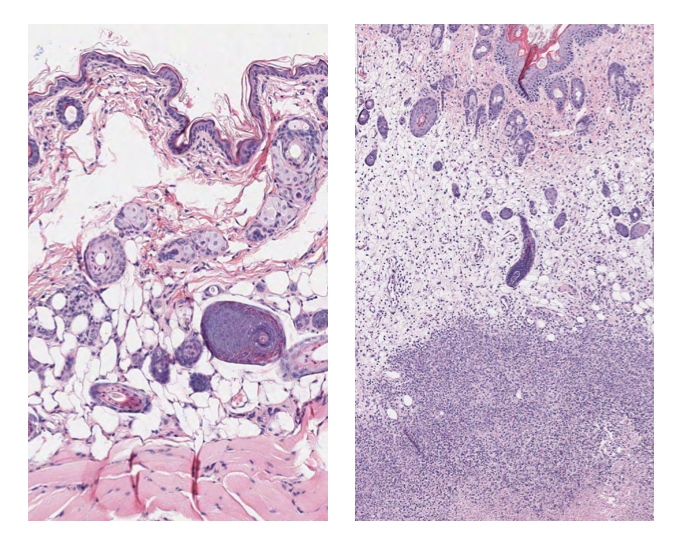
A群链球菌细菌导致多种疾病从轻微滋扰脓毒性咽喉炎等危及生命的条件包括肺炎、中毒性休克综合征和肉病正式称为坏死性筋膜炎。危及生命的感染发生时,细菌传播在皮肤表面或喉咙和入侵底层的软组织。2005年的一项研究发表在《柳叶刀》每年全世界有一百万死亡归因于a群链球菌。
“在24至48小时内,你可以从健康到截肢来挽救你的生命,”凯文说McIver,细胞生物学和分子遗传学教授马里兰大学学院公园。“我们真的不知道为什么或细菌怎么做。”
在一项新的研究中,McIver的实验室和马里兰大学医学院的研究人员发现了两个基因重要的入侵A群链球菌感染的老鼠。基因的基因,皮下健身(scfA)和B (scfB),可能是有前途的临床目标对抗这些感染,没有A群链球菌疫苗或有效治疗侵袭性感染。这项研究在线发表在2017年8月23日,在《PLOS病原体。
由雅安布列塔尼人,该研究的第一作者和研究助理教授McIver集团,研究人员发现scfA和scfB通过执行转座子整个a群链球菌基因组测序。也被称为跳跃基因转座子,短序列在基因组DNA的物理移动,跳进他们变异基因。如果突变导致一个有趣的效果,科学家可以确定突变基因定位转座子,测序DNA转座子和映射的位置周围的基因组。
“入侵皮肤或皮下注射,为A群链球菌细菌不规范;它实际上是非常罕见的,”McIver解释道。“我们假设必须有基因的细菌入侵的软组织和皮肤下生存。我们测试这一理论,利用转座子让成千上万的不同个体突变体,我们用来感染小鼠皮下环境。”
McIver和他的同事们使用了一种转座子Krmit-which他们先前的研究产生的集合中创建大约85000独特的a群链球菌株突变体。他们的突变株注入老鼠,导致人类感染。布偶角色性格的转座子名叫科密特青蛙,他的创造者吉姆亨森,1960年学院公园校友,死的中毒性休克综合征后A组链球菌肺炎。
“我们特别感兴趣的突变不出来其他的时没有找到存活的细菌从受感染的组织,“McIver说。“这些基因会好的疫苗或治疗的目标,因为细菌失踪的这些基因没有感染网站蓬勃发展。”
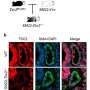
研究人员发现273年自洽场基因可能参与建立皮肤感染,但两个基因引人注目:scfA scfB。基于模式的DNA序列,这些基因可能编码蛋白质的细菌膜。这是一个基因产物参与的首要位置感染因为许多危险的细菌分泌毒素或蛋白质通过膜攻击主机。额外的实验表明,细菌缺乏scfA或scfB很难从皮肤下蔓延到血液和其他器官。
结果表明这两个基因参与了入侵过程和可能潜在的治疗目标。
“下一步将扩大包括多个动物模型的研究,而这些实验已经开始,”Mark Shirtliff说,该研究的作者之一、美国微生物学和免疫学教授和美国马里兰大学医学院的微生物发病马里兰大学牙科学院。“我们也可以开始制定改进的治疗和疫苗A群链球菌感染及其并发症如风湿性心脏病、肺炎和坏死性筋膜炎”。
McIver也期待着使用转座子测序研究其他方法细菌攻击人类。
“转座子序列可用于探测细菌是如何感染人类在任何环境中你能想到的,”McIver说。“就像A群链球菌,许多致病细菌有完全测序的基因组,但我们不知道的大部分基因在做什么。我们非常高兴有一个方法来询问所有的未知的遗传物质更好地理解人类感染”。